 Для того, чтобы более полно и правильно рассмотреть такой вопрос, как лечение ХСН, необходимо определиться с определением этого состояния, а также остановиться на классификации.
Для того, чтобы более полно и правильно рассмотреть такой вопрос, как лечение ХСН, необходимо определиться с определением этого состояния, а также остановиться на классификации.
Хроническая сердечная недостаточность — нарушение функции сердца, обусловленное дисфункцией миокарда, при котором наблюдаются такие характерные симптомы, как одышка, слабость, отеки и т. д.
Возникновение их связано с гипоперфузией тканей, вследствие чего последние страдают от гипоксии.Таким образом, ХСН — это дисбаланс между потребностями тканей в крови и возможностями сердца по её доставке.
 Исходя из того, что основным вопросом является лечение ХСН, следует рассматривать классификацию, с точки зрения, значимых для терапии особенностей. ХСН классифицируют по нескольким признакам:
Исходя из того, что основным вопросом является лечение ХСН, следует рассматривать классификацию, с точки зрения, значимых для терапии особенностей. ХСН классифицируют по нескольким признакам:
- По преимущественному поражению:
- преимущественно правожелудочковая — клинически проявляется отеками, увеличением печени, слабостью, утомляемостью и т.д.;
- преимущественно левожелудочковая — основные проявления: одышка, кашель и т.д.;
- тотальная — сочетание симптомов.
- По происхождению:
- миокардиальная (от повреждения кардиомиоцитов). В основе — первичное поражение миокарда: некроз (инфаркт), миокардит, кардиомиопатия. В медикаментозной поддержке нуждается мышца сердца;
 перегрузочная (от перегрузки). Сердечная мышца интактна, но происходит его гиперфункция из-за чрезмерной нагрузки. Последняя
перегрузочная (от перегрузки). Сердечная мышца интактна, но происходит его гиперфункция из-за чрезмерной нагрузки. Последняя
может быть обусловлена избыточным объемом притекающей крови (пороки в виде недостаточности) или повышенным сопротивлением при выбросе крови в аорту или легочный ствол (стенозы, артериальная гипертензия). Точкой приложения являются сосуды или клапаны;- смешанная — сочетание. Например, миокардит у человека с пороком сердца.
- В зависимости от фазы сердечного цикла:
- систолическая: снижена способность сердца к сокращению — низкий сердечный выброс;
- диастолическая: страдает функция расслабления сердца, а как раз в диастолу происходит его питание и наполнение кровью (подготовка к систоле);
- смешанная.
Цели лечения больных с хронической сердечной недостаточностью:
- Улучшение прогноза и, следовательно, ожидаемой продолжительности жизни.
- Улучшение качества жизни — то, чему сейчас уделяется много внимания в Европейских странах,
поскольку человек не должен страдать от своего недуга. Достижение этой цели возможно путем решения таких задач, как уменьшение выраженности симптомов, урежение госпитализаций и т. д. - Важным моментом является защита органов, страдающих при ХСН в первую очередь (органы-мишени). Защита головного мозга, почек, сосудов играет роль в достижении как первой, так и второй целей терапии.
- Модификация образа жизни
- Рациональное питание
- Физическая реабилитация
- Психологическая реабилитация
- Медикаментозная терапия
- Оперативное лечение
Модификация образа жизни и лечение
 Согласно данным ВОЗ, наши болезни на 50% обусловлены неправильным образом жизни. Касательно ХСН, необходимо добиваться от пациента отказа от вредных привычек, рационализации физической активности, соблюдения режима и т. д.
Согласно данным ВОЗ, наши болезни на 50% обусловлены неправильным образом жизни. Касательно ХСН, необходимо добиваться от пациента отказа от вредных привычек, рационализации физической активности, соблюдения режима и т. д.
Никотин капилляров токсичен, нарушает их вегетативную регуляцию. Этанол является универсальным ядом, в том числе и сосудистого действия. Поэтому сложно добиться успехов в лечении без отказа от сигарет и алкоголя.
 Многих пациентов пугает само слово диета, поэтому лучше использовать термин «рациональное питание». При сердечной недостаточности оно имеет две основные особенности. Первая — ограничение соли.
Многих пациентов пугает само слово диета, поэтому лучше использовать термин «рациональное питание». При сердечной недостаточности оно имеет две основные особенности. Первая — ограничение соли.
На 1 стадии необходим отказ от соленого, на второй запрещается досаливать, на третьей используются специальные диетические продукты с пониженным процентом NaCl. Вторая особенность — лимит на потребление жидкости (до 1,5 литров (включая первые блюда) в день). Общий принцип питания людей с патологией — пища богатая витаминами, животными белками, со сниженным содержанием холестерина, применим и в этом случае.
Физическая и психологическая реабилитация
Мысль о том, что при сердечной недостаточности противопоказана физическая активность — неправильная. Дозированная и рационально подобранная нагрузка благоприятно влияет на прогноз и повышает качество жизни.
 Однако важен профессиональный медицинский контроль, особенно при лечении хронической сердечной недостаточности у пожилых. Используют следующие методы: дозированная ходьба — полчаса в день, до 5 раз в неделю; велоэргометрия с параметрами ЧСС до 80% от максимума с той же кратностью, беговая дорожка.
Однако важен профессиональный медицинский контроль, особенно при лечении хронической сердечной недостаточности у пожилых. Используют следующие методы: дозированная ходьба — полчаса в день, до 5 раз в неделю; велоэргометрия с параметрами ЧСС до 80% от максимума с той же кратностью, беговая дорожка.
Но все же есть и противопоказания: активное воспаление — миокардит, тяжелые аритмии, стенозы клапанов. А вообще, стоит запомнить, что покой при стабильной ХСН любой стадии не показан.
Психологическая реабилитация и обучение: необходимо теоретически и практически обучать пациента и его родных клиническим проявлениям, факторам, провоцирующим декомпенсацию, самоконтролю, осуществлять консультации по вопросам питания, терапии, образа жизни и т. д. в любое время.
 Все препараты, применяемые при ХСН, по наличию доказательной базы и эффективности можно разделить на основные, дополнительные и вспомогательные.
Все препараты, применяемые при ХСН, по наличию доказательной базы и эффективности можно разделить на основные, дополнительные и вспомогательные.
Основные препараты имеют доказанную эффективность — влияют на прогноз, качество жизни, уменьшают симптомы. К ним относят ингибиторы АПФ (иАПФ), бета-блокаторы, диуретики, сердечные гликозиды, антагонисты альдостерона. Дополнительные исследованы, но не до конца и требуют наблюдения: блокаторы ангиотензиновых рецепторов (БРА), статины, антикоагулянты.
 Вспомогательные — их применение обусловлено клиникой, влияние на прогноз не выявлено — нитраты, блокаторы кальциевых каналов, аспирин и др.
Вспомогательные — их применение обусловлено клиникой, влияние на прогноз не выявлено — нитраты, блокаторы кальциевых каналов, аспирин и др.
Остановимся подробнее на самых значимых препаратах:
- Ингибиторы АПФ — периндоприл, рамиприл, лизиноприл и т. д. Являются краеугольным камнем терапии. Обладают всеми необходимыми эффектами: антигипертензивный, противоболевой, уменьшает гипоксию сердца. Блокируют ренин-ангиотензин-альдостероновую систему, играющую ключевую роль в патогенезе СН. Важнейший фармакологический эффект — прекращение ремоделирования сердца — патологического процесса реструктурирования миокарда. Поэтому они используются всегда — изолированно (редко) или в комбинации с другими препаратами.
- БРА — кандесартан, лозартан — обладают всеми эффектами иАПФ, по сути, действуя также, но по другому пути. При их применении нет выключения АПФ (который кроме патологического, обладает и физиологической функцией), что позволяет избежать нежелательных эффектов при применении. Используется вместо ингибиторов при их непереносимости.
- Бета-блокаторы (бисопролол, метопролол) — обладают теми же эффектами, плюс имеется антиаритмический фармакологический эффект для больных с высоким риском аритмий. Используются «сверху» первых двух групп.
- Диуретики — они относятся и к патогенетической, и к симптоматической терапии, в зависимости от назначенного препарата. Антагонисты альдостерона (эплеренон, альдактон) блокируют РААС, нарушая патогенез. Другие можно назвать, скорее, симптоматическими препаратами. Использование мочегонных в зависимости от стадии:
1 и  2 функциональные классы – без мочегонных, 2 класс с застоем — тиазидные препараты (торасемид), при 3 классе следует добавить альдактон. Альдактон как препарат, имеющий патогенетическое действие, можно назначать большими дозами при декомпенсации (быстрейшая нормализация водно-электролитного баланса) или
2 функциональные классы – без мочегонных, 2 класс с застоем — тиазидные препараты (торасемид), при 3 классе следует добавить альдактон. Альдактон как препарат, имеющий патогенетическое действие, можно назначать большими дозами при декомпенсации (быстрейшая нормализация водно-электролитного баланса) или
малыми дозами (+ иАПФ, бета-блокаторы) как блокатор РААС и средство длительного действия для улучшения течения болезни. При 4 ФК может назначаться мочегонное еще из одной группы — ингибитор карбоангидразы — диакарб, потенциирующий действие других диуретиков.
Сердечные гликозиды (дигоксин, строфантин) — группа препаратов — алкалоидов, оказывающих положительное инотропное действие (сила сердечных сокращений растет). Ранее эти препараты назначали всем больным, но в дальнейшем от такого их использования пришлось отказаться, поскольку эффект развивался не всегда, а зачастую еще и развивалась интоксикация дигиталисом, проявляющаяся тяжелой аритмией.
 Сейчас, при наличии современных препаратов, дигоксин лишь на 4 месте в случае, если у пациента определяется синусовый ритм сердца.
Сейчас, при наличии современных препаратов, дигоксин лишь на 4 месте в случае, если у пациента определяется синусовый ритм сердца.
Но сердечные гликозиды сохраняют свое значение у лиц с хронической сердечной недостаточностью для лечения мерцательной аритмии, при сниженной фракции выброса.
Вообще, низкий сердечный выброс рассматривается как один из предикторов успеха лечения этими препаратами.
В последние годы появились некоторые новые препараты с отличными от основных механизмами действия. К ним относятся омакор и кораксан.
 Кораксан блокирует If каналы синусового узла — главного элемента проводящей системы сердца. В итоге отмечается снижение симпатической активности, нормализация процесса диастолы, уменьшение ЧСС, наблюдается антигипоксический эффект в отношении миокарда, препятствует возникновению аритмий, уменьшает ремоделирование, останавливает гибель кардиомиоцитов.
Кораксан блокирует If каналы синусового узла — главного элемента проводящей системы сердца. В итоге отмечается снижение симпатической активности, нормализация процесса диастолы, уменьшение ЧСС, наблюдается антигипоксический эффект в отношении миокарда, препятствует возникновению аритмий, уменьшает ремоделирование, останавливает гибель кардиомиоцитов.
В исследованиях было выявлено, что ивабрадин (кораксан) достоверно уменьшает смертность от сердечно-сосудистых причин и частоту госпитализаций при ХСН на 18%. Кроме всего, его отличает низкая частота неблагоприятных эффектов.
Омакор — представляет собой смесь полиненасыщенных кислот жирного ряда (семейство омега-3). Они встраиваются в мембраны кардиомиоцитов и нормализуют их функцию (особенно подвергшихся ишемии). Достоверно улучшает прогноз у людей, перенесших инфаркт миокарда.
Дополнительные и вспомогательные препараты
 Антиагреганты и антикоагулянты — назначают лицам, имеющих склонность к тромбозам. Важное показание к применению их — мерцательная аритмия, часто осложняющаяся тромбоэмболией головного мозга и инсультами. Могут быть использованы следующие действующие вещества: аспирин в дозировке 0.125 г, трентал, клопидогрель и т. д.
Антиагреганты и антикоагулянты — назначают лицам, имеющих склонность к тромбозам. Важное показание к применению их — мерцательная аритмия, часто осложняющаяся тромбоэмболией головного мозга и инсультами. Могут быть использованы следующие действующие вещества: аспирин в дозировке 0.125 г, трентал, клопидогрель и т. д.
Статины — средства, нормализующие обмен липидов (холестерина и триглицеридов). Препараты этиотропной терапии атеросклероза, который в подавляющем большинстве случаев и приводит к ХСН. Препараты — розувастатин, аторвастатин.
Нитраты — как периферические сосудорасширяющие средства. Используют для купирования мучительной боли при стенокардии, не влияют на течение заболевания.
Блокаторы кальциевых каналов — назначаются также при стенокардии, но отличающейся своей рефрактерностью (устойчивостью к терапии). Используют длительно действующий амлодипин.
Выделяют следующие принципы совместного использования препаратов при лечении:
Монотерапия используется редко, не входит в стандарты лечения, потому что не дает значимых результатов. Может быть применена в начальной стадии. В таком случае следует назначать ингибиторы АПФ.
 Двойная терапия раньше имела большой успех, но сейчас, в связи с патоморфозом болезни, этого недостаточно. Выделяют следующие комбинации — иАПФ + диуретик (Энап Н), диуретик + гликозид, БРА+диуретик (Лозап Н).
Двойная терапия раньше имела большой успех, но сейчас, в связи с патоморфозом болезни, этого недостаточно. Выделяют следующие комбинации — иАПФ + диуретик (Энап Н), диуретик + гликозид, БРА+диуретик (Лозап Н).
Следующим шагом стала тройная терапия (иАПФ + диуретик + гликозид). Она была популярна в 80-х годах, да и сейчас вполне действенна, однако с условием замены гликозида на препарат из блокаторов бета-адренорецепторов. Золотым же стандартом лечения ХСН у пожилых сейчас является комбинация из 4 лекарств: ингибитор, диуретик, БАБ и дигоксин.
При неэффективности консервативного лечения, при тотальной сердечной недостаточности, прибегают к оперативному вмешательству.
 Выделяют следующие виды операций:
Выделяют следующие виды операций:
- Аортокоронарное шунтирование. При выраженном стенозе сосудов. Формируется обход стенозированного участка с помощью аутовены или трансплантата. Первая из всех операций при этой патологии.
- Хирургическая коррекция пороков. Операция требуется при выраженном стенозе либо недостаточности клапана.
- Стентирование — введение через бедренную артерию под контролем УЗИ баллончика (стента) до места сужение и «раскрытие» его там с закреплением на внутренней стенке сосуда поддерживающей каркасной сеточки, расширяющей просвет сосуда.
- Трансплантация органа — радикальная операция при отсутствии эффекта от других видов лечения. Однако существует ряд юридических и медицинских сложностей: возможным отторжением, недостаточным числом органов, отсутствием воздействия на причину (новое сердце будет поражено впоследствии, как и старое).
 Применение аппаратов вспомогательного кровообращения. Они внедряются в организм, на коже выводятся провода к аккумуляторам, расположенным на поясе у пациента. Но и здесь встречаются осложнения: инфекционные, тромбоэмболии и т. д. Еще одним минусом является огромная цена аппаратов. Препятствует более обширному применению аппаратов и их высокая стоимость.
Применение аппаратов вспомогательного кровообращения. Они внедряются в организм, на коже выводятся провода к аккумуляторам, расположенным на поясе у пациента. Но и здесь встречаются осложнения: инфекционные, тромбоэмболии и т. д. Еще одним минусом является огромная цена аппаратов. Препятствует более обширному применению аппаратов и их высокая стоимость.- Использование эластичной сетки, которой окутывают сердце при расширении полостей (дилатационной кардиомиопатии). Это останавливает прогрессирование дилатации, повышается эффективность терапии, улучшается прогноз и качество жизни.
Источник: vseoserdce.ru

О недостаточности того или иного органа мы обычно говорим, когда он не в состоянии в полном объеме выполнять свои функции. Функция сердца заключается в выбросе в аорту количества крови, адекватного потребностям организма. Таким образом, сердечная недостаточность (СН) может быть определена как нарушение структуры и функции сердечной мышцы, ведущее к неспособности переносить кислород в том количестве, которое необходимо для тканевого метаболизма [12].
Основной причиной является повреждение миокарда, ведущее к патологическому ремоделированию желудочка вследствие расширения камеры и нарушения сократимости. Эти изменения приводят к снижению сердечного выброса, уменьшению перфузии органов и активации компенсаторных нейрогормональных систем [39].
Главными проявлениями сердечной недостаточности являются одышка и утомляемость. Эти симптомы могут ухудшить функциональные возможности и качество жизни пациентов [8].
Если объем поражения достаточно велик, то в первый момент произойдет падение выброса крови из левого желудочка и снижение ее давления на стенки аорты и крупных сосудов. Это приведет к активации расположенных там барорецепторов. Ответом будет немедленная активация симпато-адреналовой системы (САС). Стимуляция находящихся в сердце β-рецепторов ведет к увеличению ЧСС и повышению сократимости миокарда. Стимуляция находящихся в стенке сосудов рецепторов катехоламинами вызывает реакцию централизации кровотока, а за счет спазма вен увеличивается возврат крови к сердцу во время диастолы [39].
Активация САС ведет к активации ренин-ангиотензин-альдостероновой системы (РААС) [3, 12].
Ренин является ферментом превращающим физиологически неактивный ангиотензиноген в ангиотензин-1. Последний под влиянием ангиотензинпревращающего фермента превращается в одно из наиболее биологически активных веществ – ангиотензин-2. Его образование существенно усиливает спазм сосудов, обусловленный реакцией централизации кровотока. Помимо вазоконстрикции ангиотензин-2 вызывает рост клеток, способствует апоптозу и,что важно в данном случае, увеличивает синтез альдостерона. Альдостерон способствует реабсорбции жидкости в дистальных отделах нефрона. Таким образом, возникающая в ответ на повреждение миокарда активация САС и РААС приводит к постепенному накоплению избытка жидкости в организме. Этот процесс требует времени и достигает клинически значимого эффекта только спустя несколько суток после острой сердечной катастрофы [12].
Несмотря на серьезные достижения в лечении хронической сердечной недостаточности, терапия острой сердечной недостаточности остается практически неизменной. В частности, лечение острой сердечной недостаточности во многом основывается не на доказательной медицине, а на эмпирических данных [15].
Острая сердечная недостаточность (ОСН) – синдром, характеризующийся застойными явлениями по малому и/или большому кругу кровообращения вследствие увеличения давления наполнения левого желудочка с или без уменьшения сердечного выброса. Риск смерти и повторной госпитализации больных ОСН после выписки из стационара остаётся высоким и составляет от 10 до 20%, и от 20 до 30% – в течение180 дней, соответственно [15].
Если отбросить все остальное, то все, что требует организм от сердца, это поддержать кровоток на должном уровне. Сердечный выброс (СВ) – это производное частоты сердечных сокращений (ЧСС) и ударного объема (УО) сердца (объема крови, выталкиваемого из желудочков в ходе каждого сокращения). Увеличение ЧСС является важным ранним компенсаторным механизмом, нормальным ответом сердца на снижение СВ. У здоровых молодых людей СВ возрастает при росте ЧСС до 170–180 уд./мин, а затем начинает снижаться (так как продолжительность диастолы становится слишком короткой для того, чтобы обеспечить достаточное наполнение желудочков). У пожилых пациентов с дисфункцией сердца падение СВ наблюдается при ЧСС менее 150 уд./мин. Имеется три основных фактора, определяющих УО желудочков: преднагрузка, постнагрузка и сократимость миокарда [10, 34].
Преднагрузка характеризует напряжение стенки желудочка в конце диастолы (при максимальном наполнении сердца перед сокращением). Это напряжение трудно измерить, а в качестве «суррогата» (или максимально приближенного показателя) обычно используется конечно-диастолическое давление (КДД). Эта величина определяется венозным возвратом и дает представление о давлении заполнения желудочков [7].
Сократимость — работа, производимая сердцем на данном уровне преднагрузки и постнагрузки. Определяется максимальной скоростью, с которой желудочек может генерировать изменение давления за единицу времени. Понятие «инотропизм» используется для объяснения усиления работы, выполняемой сердцем, независимо от ЧСС, преднагрузки и постнагрузки [7].
Постнагрузка — это напряжение, которое должно быть сгенерировано в стенке желудочка для того, чтобы выбросить кровь во время систолы в артериальную систему. Этот показатель находится под сильным влиянием сопротивления артерий — системного сосудистого сопротивления [7].
В интактном сердце длина мышечных волокон пропорциональна конечному диастолическому объему (КДО) желудочков. Поэтому увеличение наполнения желудочков во время диастолы (или рост преднагрузки) вызывает рост силы последующего сокращения и увеличение УО и СВ. Вот почему факторы, способствующие увеличению объема внутрисосудистой жидкости (а именно – задержка натрия и воды) являются одними из основных компенсаторных механизмов СН. В этом случае увеличение объема внутрисосудистой жидкости приводит к росту венозного возврата к обоим желудочкам, увеличению их КДО и, в конце концов, к повышению УО. Исходя из того, что увеличение преднагрузки способствует росту УО и СВ, можно было бы предположить, что лечение, направленное на повышение объема внутрисосудистой жидкости, было бы полезным в тех случаях, когда функция желудочков угнетена. Но основная проблема такого «лечения» заключается в том, какой именно объем внутрисосудистой жидкости необходим для оптимальной преднагрузки и как его определить у конкретного пациента [10].
В начальной стадии СН снижение сократимости желудочка компенсируется повышением преднагрузки (КДО и КДД), что приводит к нарастанию ударного объема; кроме того, увеличивается частота сердечных сокращений (ЧСС). По мере прогрессирования СН повышение КДД в желудочке все меньше сказывается на ударном объеме; вместе с тем растет давление в венах малого и большого круга кровообращения, вызывая симптомы застоя. Повышается напряжение в стенке желудочка и снижается коронарный кровоток в диастолу, вследствие ухудшается энергетический баланс миокарда [2].
Сопряжение возбуждения и сокращения в миокарде
Когда мембранный потенциал достигает уровня –65 мВ, открываются потенциалзависимые кальциевые каналы L-типа, обеспечивающие формирование входящего кальциевого тока, который ускоряет деполяризацию кардиомиоцитов. В результате активируются потенциалзависимые кальциевые ионные каналы мембраны T-трубочек и рианодиновые рецепторы саркоплазматического ретикулума. Резкое повышение концентрации ионов кальция в саркоплазме устраняет тропомиозиновую блокаду взаимодействия актина и миозина и запускает процесс сокращения кардиомиоцитов. Следовательно, сократимость сердечной мышцы непосредственно зависит от силы входящего кальциевого тока [3, 5]. Существует и другой механизм поступления больших количеств ионов кальция в цитоплазму рабочего кардиомиоцита при его возбуждении. Он обеспечивается сопряженным транспортом ионов кальция и натрия через мембрану, то есть натрий-кальциевым обменом. Во время диастолы натрий-кальциевая помпа активно удаляет из клетки ионы кальция в обмен на ионы натрия. При возбуждении кардиомиоцита направление натрий-кальциевого обмена меняется на противоположное: ионы кальция активно переносятся в клетку, тогда как ионы натрия, напротив, удаляются, и в результате концентрация ионов кальция в цитоплазме кардиомиоцита возрастает [5, 26].
Комплекс актина и тропонина
Несмотря на то, что ионы кальция, соединяясь с ТрС (тропонин С), дают сигнал к запуску цикла поперечных мостиков, есть доказательства, что начинается не только сигнальный процесс включения-выключения. Чтобы понять роль кальция, нужно описать молекулярную структуру комплекса актина и тропонина. Тонкие филаменты состоят из двух актиновых частей, сплетенных в спираль; обе части находятся на более тяжелой молекуле тропомиозина, которая играет роль стержня. С равными интервалами к этим закручивающимся структурам прикреплены три регуляторных белка, называемых тропониновым комплексом. ТрС состоит из короткого N-концевого домена и четырех кальций?связывающих EF-рук, объединенных попарно в глобулярный N-концевой и С-концевой домены [6, 20].
Распространение потенциала действия по мышечному волокну в начале систолы приводит к выходу ионов кальция из саркоплазматического ретикулума и повышению концентрации свободного кальция в цитоплазме. Присоединение кальция ко второй EF-руке ТрС приводит к изменению конформации всего N-концевого домена белка. При этом появление на поверхности N-концевого домена ТрС гидрофобной области, с которой связывается регуляторный домен ТрI (тропонин I). Он перемещается на новое место на тонком филаменте, ослабляя таким образом взаимодействие между ТрТ (тропонин Т) и тропомиозином. В результате тропомиозин перемещается по тонкому филаменту, и устраняется торможение, оказываемое тропомиозином на взаимодействие актина и миозина [6, 20].
АТФ как источник энергии для сокращения
Сокращение сердечной мышцы происходит благодаря скольжению тонких актиновых филаментов относительно толстых миозиновых. Данный процесс обеспечивается за счет циклического АТФ-зависимого взаимодействия миозина и актина. Миозин связывает и гидролизует АТФ до АДФ и неорганического фосфата, но при этом практически не способен избавляться от накопившихся в активном центре продуктов АТФазной реакции. Головка миозина, содержащая в своем составе АДФ и фосфат, способна слабо взаимодействовать с актином, что активирует процесс освобождения фосфата из активного центра миозина. Освобождение неорганического фосфата (а вслед за этим и АДФ) из активного центра миозина сопровождается изменением ориентации «шейки» головки миозина, протягиванием нити актина относительно головки миозина и развитием натяжения. Связывание новой молекулы АТФ приводит к диссоциации миозина от актина и после гидролиза АТФ происходит очередное циклическое присоединение головки миозина к актину и осуществляется новый «шаг» миозина по актину [3].
В цикле поперечных мостиков АТФ выполняет две разные роли:
1) гидролиз АТФ поставляет энергию для движения поперечного мостика;
2) связывание (но не гидролиз) АТФ с миозином сопровождается отделением миозина от актина и создает возможность повторения цикла поперечных мостиков [1].
Миозиновая АТФазная активность реагирует на воздействие кальция следующим образом: во время цикла сокращения сердца концентрация кальция повышается, что ведет к повышению миозиновой АТФазной активности в несколько раз, а также к повышению присоединения кальция к ТрС [3].
Подходы к лечению сердечной недостаточности
Подходы к лечению сердечной недостаточности менялись неоднократно. В 50-60 годах 20 века основной терапией считали инотропную стимуляцию сердца, в 70-х упор делался на борьбу с задержкой жидкости, в 80-е надежды связывали с уменьшением нагрузки на сердце за счет использования вазодилататоров, в 80-х годах синтезировала ингибитор фосфодиэстеразы III (ФДЭ III), за двойной эффект – инотропное и вазодилатирующее, названное инодилататорами. Начиная с 90-х основой лечения стало подавление избыточной активации нейрогуморальных систем [12].
Механизм действия инотропных препаратов
Препараты, обычно используемые для достижения положительного иноторопного эффекта, включают катехоламины, напр. добутамин, и ингибиторы ФДЭ III, напр. милринон. У этих веществ разные точки приложения, но они, в конечном счете, запускают каскад событий, приводящих к улучшению сократимости путем увеличения концентрации внутриклеточного кальция. Взаимодействие катехоламинов с β1-адренорецепторами на поверхности кардиомиоцитов активирует аденилатциклазу, катализирующую превращение АТФ в цАМФ. цАМФ активирует протеинкиназу А, которая, в свою очередь, фосфорилирует внутриклеточные субстраты, включая потенциалзависимые кальциевые каналы L-типа, фосфоламбан, ТрI. Фосфорилирование потенциалзависимых кальциевые каналов L-типа стимулирует поступление кальция в цитозоль. Это является триггером для открытия рианодиновых рецепторов саркоплазматического ретикулума и мышечного сокращения (положительное инотропное действие катехоламинов и ингибиторов ФДЭ III). В то же время фосфорилирование фосфоламбана активирует SERCA2, что приводит к обратному захвату кальция саркоплазматическим ретикулумом во время диастолы. Это обусловливает люзитропный эффект катехоламинов и ингибиторов ФДЭ III. Также фосфорилирование ТрI уменьшает сродство миофиламентов к кальцию и способствует релаксации. Сердечные гликозиды, напр. дигоксин, селективно и обратимо ингибируют сарколеммальную натрий-калиевую АТФазу кардиомиоцитов, повышая т.о. концентрацию натрия внутри клетки, что, в свою очередь, ингибирует выкачивание кальция из клетки натрий-кальциевой помпой. Омекатив мекарбил – новый препарат – активатор миозина. Активирует миозиновую АТФазу [26, 32, 33].
За исключением дигоксина, не оказывающего эффекта на общую смертность, имеющиеся препараты с положительным инотропным действием, включая агонисты β1-адренорецепторов, ингибиторы ФДЭ III, оказались вредны для долгосрочного лечения СН, т.к. они могут способствовать развитию злокачественных желудочковых тахиаритмий и увеличить риск внезапной сердечной смерти. Также короткосрочное применение ингибиторов ФДЭ III ассоциируется с частым возникновением таких осложнений, как фибрилляция предсердий, гипотензия, особенно если у пациента имеется ишемия миокарда ввиду ишемической кардиомиопатии. Причины столь разочаровывающих открытий кроются в том, что, несмотря на различные точки приложения, все эти препараты усиливают сократимость миокарда путем увеличения внутриклеточного уровня цАМФ в кардиомиоцитах или благодаря его усиленному синтезу (при приеме агонистов β1-адренорецепторов), или снижению скорости его деградации (при приеме ингибиторов ФДЭ III), что усиливает высвобождение кальция из саркоплазматического ретикулума в цитозоль. Увеличение внутриклеточного кальция, в свою очередь, ведет к временному улучшению сократимости миокарда ценой увеличения потребления миокардом энергии и потребности в кислороде, что в итоге ведет к клеточной смерти. Более того, увеличение концентрации цАМФ и изменение обмена кальция кардиотоксичны и могут привести к нарушениям ритма [17].
Инотропные препараты существенно увеличивают энергетические затраты кардиомиоцитов. Увеличение внутриклеточного кальция ведет к временному улучшению сократимости миокарда ценой увеличения потребления миокардом энергии и потребности в кислороде, что в итоге ведет к клеточной смерти. Более того, увеличение концентрации цАМФ и изменение обмена кальция кардиотоксичны и могут привести к нарушениям ритма [19].
Было проведено значительное количество исследований, направленных на поиск нового инотропного препарата, действие которого не имеет под собой увеличения кальция в клетке. В теории такой препарат должен был усиливать сократимость без увеличения потребности миокарда в кислороде и без риска возникновения аритмий. Т.к. связь между уровнем внутриклеточного кальция и взаимодействием миофиламентов может быть нарушена ввиду таких патофизиологических состояний, как ишемия, ацидоз, сепсис или гипотермия, разрабатываемый препарат должен был укреплять эту связь, но не изменять внутриклеточную концентрацию кальция. Все «сенситизаторы кальция», включая левосимендан, пимобендан, EMD 57033, ORG 30029, MCI-154 и другие, имеют способность усиливать сократимость миокарда путем увеличения чувствительности миофиламентов к кальцию с различной интенсивностью, с помощью различных механизмов и точек приложения и различной степенью одновременного ингибирования фосфодиэстеразы III. Среди этих препаратов левосимендан наиболее эффективен в лечении хронической и острой левожелудочковой недостаточности [20].
Регистрационное свидетельство препарату левосимендан впервые было предоставлено в 2000 году в Швеции. В настоящее время левосимендан обладает
регистрационным свидетельством в более чем 50 странах по всему миру, при
этом установлено, что на декабрь 2014 года более 800 000 пациентов получили
инфузию препарата в рамках рутинной клинической практики [14].
Левосимендан – сенситизатор кальция, инодилататор, разработанный для внутривенного применения у пациентов, госпитализированных с острой декомпенсированной сердечной недостаточностью (ОДСН). Фармакологические действия левосимендана включают:
а) повышение сократимости сердца благодаря сенситизации тропонина С к кальцию;
б) вазодилатацию вследствие открытия калиевых каналов саркоплазматической мембраны в гладкомышечных клетках сосудов;
в) кардиопротекцию благодаря открытию митохондриальных калиевых каналов в кардиомиоцитах [25, 26, 31].
Источник: eduherald.ru

Войти через uID
Современные методы диагностики и лечения хронической сердечной недостаточности
Современные методы лечения ХСН
ХРОНИЧЕСКАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Хроническая сердечная недостаточность (ХСН) — кардиально обусловленное нарушение (насосной) функции с соответствующими симптомами, заключающееся в неспособности системы кровообращения доставлять органам и тканям необходимое для их нормального функционирования количество крови.
Таким образом, это диспропорция между состоянием кровообращения и обменом вешеств, которая нарастает с увеличением активности жизненных процессов; патофизиологическое состояние, при котором нарушение функции сердца не позволяет ему поддерживать уровень кровообращения, необходимый для метаболизма в тканях.
С современных клинических позиций ХСН представляет собой заболевание с комплексом характерных симптомов (одышка, утомляемость и снижение физической активности, отеки и др.), которые связаны с неадекватной перфузией органов и тканей в покое или при нагрузке и часто с задержкой жидкости в организме.
Первопричиной является ухудшение способности сердца к наполнению или опорожнению, обусловленное повреждением миокарда, а также дисбалансом вазоконстрикторных и вазодилатирующих нейрогуморальных систем. Казалось бы мелочь: раньше синдром, теперь болезнь.
Это трудно было бы себе представить, если бы не появились данные о том, что ХСН четко ассоциируется с поломом конкретных генов, а это уже «тянет» на нозологию.
Для хронической сердечной недостаточности характерны периодически возникающие эпизоды обострения (декомпенсации), проявляющиеся внезапным или, что бывает чаще, постепенным усилением симптомов и признаков ХСН.
Эпидемиология. Распространенность клинически выраженной ХСН в популяции не менее 1,8-2,0%.
Среди лиц старше 65 лет частота встречаемости ХСН возрастает до 6—10%, и декомпенсация становится самой частой причиной госпитализации пожилых больных.
Число больных с бессимптомной дисфункцией ЛЖ не менее чем в 4 раза превышает количество пациентов с клинически выраженной ХСН.
За 15 лет число госпитализаций с диагнозом ХСН утроилось, а за 40 лет увеличилось в 6 раз.
Пятилетняя выживаемость больных с ХСН все еще ниже 50%. Риск внезапной смерти в 5 раз выше, чем в популяции.
В США насчитывается более 2,5 млн больных с ХСН, ежегодно умирает около 200 тыс. пациентов, 5-летняя выживаемость после появления признаков ХСН составляет 50%.
Причины. ХСН может развиться на фоне практически любого заболевания сердечно-сосудистой системы, однако основными тремя являются следующие наднозологические формы: ИБС, артериальные гипертензии и сердечные пороки.
ИБС. Из существующей классификации особенно часто острый инфаркт миокарда (ОИМ) и ишемическая кардиомиопатия (ИКМП — нозологическая единица, введенная в клиническую практику МКБ—10) приводят к развитию ХСН.
Механизмы возникновения и прогрессирования ХСН вследствие ОИМ обусловлены изменением геометрии и локальной сократимости миокарда, названным термином «ремоделирование левого желудочка» (ЛЖ), при ИКМП имеет место снижение тотальной сократимости миокарда, названное термином «гибернация («спячка») миокарда».
Артериальные гипертензии. Вне зависимости от этиологии гипертензии происходит структурная перестройка миокарда, имеющая специфическое название — «гипертоническое сердце». Механизм ХСН в данном случае обусловлен развитием диастолической дисфункции ЛЖ.
Сердечные пороки. Для России до настоящего времени характерно развитие ХСН вследствие приобретенных и некорригированных ревматических пороков.
Несколько слов необходимо сказать о дилатационной кардиомиопатии (ДКМП) как о причине ХСН.
ДКМП — заболевание достаточно редкое, неуточненной этиологии, которое развивается в относительно молодом возрасте и быстро приводит к сердечной декомпенсации.
Установление причины ХСН необходимо для выбора тактики лечения каждого конкретного больного.
Принципиальная «новизна» современных представлений о патогенезе ХСН связана с тем фактом, что далеко не все больные имеют симптомы декомпенсации в результате снижения насосной (пропульсивной) способности сердца.
Важными факторами на пути развития и прогрессировать ХСН являются снижение сердечного выброса (у большинства больных), задержка натрия и избыточной жидкости в организме.
С точки зрения современной теории, основную роль в активизации компенсаторных механизмов (тахикардия, механизм Франка-Старлинга, констрикция периферических сосудов) играет гиперактивация локальных или тканевых нейрогормонов. В основном это симпатико-адреналовая система (САС) и ее эффекторы — норадреналин и адреналин и ренин-ангиотензин- альдостероновая система (РААС) и ее эффекторы — ангиотензин II (А-11) и альдостерон, а также система натрийуретических факторов.
Проблема заключается в том, что «запущенный» механизм гиперактивации нейрогормонов является необратимым физиологическим процессом.
Со временем кратковременная компенсаторная активация тканевых нейрогормональных систем переходит в свою противоположность — хроническую гиперактивацию.
Последняя сопровождается развитием и прогрессированием систолической и диастолической дисфункции ЛЖ (ремоделирование). При повреждении сердца ударный объем желудочка будет уменьшаться, а конечно-диастолический объем и давление в этой камере расти.
Это увеличивает конечно-диастолическое растяжение мышечных волокон, что приводит к большему систолическому их укорочению (закон Старлинга).
Механизм Стерлинга помогает сохранить СВ, но результирующий хронический подъем диастолического давления будет передаваться на предсердия, легочные вены или вены большого круга кровообращения. Увеличивающееся капиллярное давление сопровождается транссудацией жидкости с развитием отеков. Уменьшенный СВ, особенно при снижении АД, активизирует САС, симулирующую сокращения миокарда, частоту сердечных сокращений, венозный тонус, а уменьшение перфузии почек ведет к снижению скорости гломерулярной фильтрации, обратному всасыванию воды и хлорида натрия, активации РААС.
Гипоксия тканей при ХСН является не только результирующим звеном патогенеза, но и фактором, имеющим непосредственное провоцирующее действие на остальные ведущие его компоненты — снижение насосной способности сердца, преднагрузку, после-нагрузку и ритм сердца. Гипоксия является сложным мультикомпонентным, многоступенчатым процессом. Прямые первичные эффекты гипоксии направлены на мишени, локализованные на самых различных уровнях: организменном, системном, клеточном и субклеточном. На субклеточном уровне гипоксия инициирует развитие апоптоза [Бойцов С.А.. 1995].
Результатом описанных процессов является увеличение периферического сосудистого сопротивления и ОЦК с соответствующим ростом постнагрузки и преднагрузки.
Наиболее удобна и отвечает запросам практики функциональная классификация Нью-Йоркской ассоциации сердца, предполагающая выделение четырех функциональных классов по способности больных переносить физические нагрузки.
Эта классификация рекомендована к использованию ВОЗ.
Принцип, заложенный в ее основу, — оценка физических (функциональных) возможностей пациента, которые могут быть выявлены врачом при целенаправленном, тщательном и аккуратном сборе анамнеза, без применения сложной диагностической техники.
Выделено четыре функциональных класса (ФК) ХСН.
I ФК. Больной не испытывает ограничений в физической активности. Обычные нагрузки не провоцируют возникновения слабости (дурноты), сердцебиения, одышки или ангинозных болей.
II ФК. Умеренное ограничение физических нагрузок. Больной комфортно чувствует себя в состоянии покоя, но выполнение обычных физических нагрузок вызывает слабость (дурноту), сердцебиение, одышку или ангинозные боли.
III ФК. Выраженное ограничение физических нагрузок. Больной чувствует себя комфортно только в состоянии покоя, но меньшие, чем обычно, физические нагрузки приводят к развитию слабости (дурноты), сердцебиения, одышки или ангинозных болей.
IV ФК. Неспособность выполнять какие-либо нагрузки без появления дискомфорта. Симптомы сердечной недостаточности или синдром стенокардии могут проявляться в покое. При выполнении минимальной нагрузки нарастает дискомфорт.
Проще всего определить ФК у пациентов можно по дистанции 6-минутной ходьбы.
Этот метод широко используется в последние 4—5 лет в США, в том числе и в клинических исследованиях.
Состояние пациентов, способных за 6 мин преодолеть от 426 до 550 м, соответствует легкой ХСН; от 150 до 425 м — средней, а тех, кто не способен преодолеть и 150 м, — тяжелой декомпенсации.
Таким образом, функциональная классификация ХСН отражает способность больных к выполнению физических нагрузок и очерчивает степень изменений функциональных резервов организма.
Это особенно значимо при оценке динамики состояния больных.
Клинические проявления. У большинства больных первично развивается недостаточность левого сердца. Наиболее частой жалобой является инспираторная одышка, вначале связанная с физической нагрузкой и прогрессирующая до ортопноэ, пароксизмальной постуральной, до одышки в покое. Характерны жалобы на непродуктивный кашель, никтурию. Больные с ХСН отмечают слабость, утомляемость, которые являются результатом уменьшенного кровоснабжения скелетных мышц и ЦНС.
При правожелудочковой недостаточности появляются жалобы на боль в правом подреберье из-за застоя в печени, потерю аппетита, тошноту из-за отека кишки или уменьшенной гастроинтестинальной перфузии, периферические отеки.
При осмотре можно отметить, что часть больных, даже с выраженной ХСН, в покое выглядят хорошо, у других одышка появляется при разговоре или минимальной активности; больные с длительным и тяжелым течением выглядят кахексичными, цианотичными.
У части больных находят тахикардию, артериальную гипотензию, падение пульсового давления, холодные конечности, потливость (признаки активации САС).
При обследовании сердца выявляется сердечный толчок, расширенный или приподнимающий верхушечный толчок (дилатация или гипертрофия желудочков), ослабление I тона, протодиастолический ритм галопа.
При левожелудочковой недостаточности выслушиваются жесткое дыхание, сухие хрипы (застойный бронхит), крепитация в базальных отделах легких, может определяться тупость в базальных отделах (гидроторакс). При правожелудочковой СН выявляются набухшие яремные вены, увеличение печени; небольшое надавливание на нее может увеличить набухание яремных вен — положительный гепатоюгулярный рефлекс.
Асцит и анасарка появляются у части больных.
Диагностика ХСН.
остановка диагноза ХСН возможна при наличии 2-х ключевых критериев:
1) характерных симптомов СН (главным образом, одышки, утомляемости и ограничении физической активности, отеков лодыжек);
2) объективного доказательства того, что эти симптомы связаны с повреждением сердца, а не каких-либо других органов (например, с заболеваниями легких, анемией, почечной недостаточностью).
Следует подчеркнуть, что симптомы ХСН могут присутствовать в покое и/или при нагрузке.
В то же время объективные признаки дисфункции сердца должны обязательно выявляться в покое.
Это связано с тем, что появление такого признака (например, низкой ФВ ЛЖ) на нагрузке (например, у больного ИБС) может быть признаком не СН, а коронарной недостаточности.
По аналогии с ФВ ЛЖ, это касается и других объективных признаков повреждения миокарда.
В сомнительных случаях подтверждением диагноза СН может служить положительный ответ на терапию, в частности, на применение диуретиков.
Стандартный диагностический набор лабораторных исследований у пациента с СН должен включать определение уровня гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, концентрации электролитов плазмы, креатинина, глюкозы, печеночных ферментов и общий анализ мочи.
Также по мере необходимости возможно определение уровня С-реактивного белка (исключение воспалительной этиологии заболевания сердца), тиреотропного гормона (исключение гипер- или гипотиреоза), мочевины и мочевой кислоты плазмы. При резком ухудшении состояния пациента целесообразно оценить содержание кардиоспецифических ферментов с целью исключения острого ИМ.
Анемия относится к фактору, усугубляющему течение ХСН. Повышенный гематокрит может свидетельствовать о легочном происхождении одышки, а также быть следствием цианотических пороков сердца или легочной артерио-венозной фистулы.
Повышение уровня креатинина у больного ХСН может быть:
• связано с первичной патологией почек;
• следствием сопутствующего заболевания или состояния (АГ, СД, пожилой возраст);
• следствием СН (гипоперфузия почки, застойная почка);
• связано с избыточным приемом диуретиков и/или иАЛФ.
При застое крови в печени может наблюдаться повышение активности печеночных ферментов.
Проведение анализа мочи целесообразно для выявления протеинурии и глюкозурии, что позволит сделать заключение о возможном наличии независимой первичной почечной патологии или СД — состояний, провоцирующих развитие или усугубляющих течение СН.
Гипонатриемия и признаки дисфункции почек при СН указывают на неблагоприятный прогноз.
Эхокардиография. Это визуализирующая методика, которой отводится первостепенная роль в диагностике ХСН в силу простоты выполнения, безопасности и повсеместной распространенности.
ЭхоКГ позволяет решить главную диагностическую задачу — уточнить сам факт дисфункции и ее характер, а также провести динамическую оценку состояния сердца и гемодинамики.
Важнейшим гемодинамическим параметром является ФВ ЛЖ, отражающая сократительную способность миокарда ЛЖ.
Нормальный уровень ФВ ЛЖ лучше определять для каждой лаборатории свой.
Это связано с популяционными особенностями населения, оборудованием, методами подсчета и т. д.
В литературе «нормальный» уровень варьирует от величины ФВ > 50% (MONICA, V-HeFT-I) до величины > 35% (SOLVD).
В качестве «усредненного» показателя можно рекомендовать «нормальный» уровень ФВ ЛЖ > 45%, подсчитанный методом 2-мерной ЭхоКГ no Simpson.
Методы оценки тяжести ХСН. Оценка тяжести состояния больного и особенно эффективности проводимого лечения является насущной задачей каждого практического врача.
С этой точки зрения необходим единый универсальный критерий состояния больного с ХСН.
Именно динамика ФК при лечении позволяет объективно решить, правильны ли и успешны ли наши терапевтические мероприятия.
Проведенные исследования доказали и тот факт, что определение ФК в известной степени предопределяет и возможный прогноз заболевания. Использование простого и доступного 6-минутного теста коридорной ходьбы дает возможность количественно измерить тяжесть и динамику состояния больного с ХСН при лечении и его толерантность к физическим нагрузкам.
Кроме динамики ФК и толерантности к нагрузкам для контроля за состоянием больных с ХСН применяются оценка клинического состояния пациента (выраженность одышки, диурез, изменения массы тела, степень застойных явлений и т. п.); динамика ФВ ЛЖ (в большинстве случаев по результатам эхокардиографии); оценка качества жизни больного, измеряемая в баллах при использовании специальных опросников, наиболее известным из которых является опросник Миннесотского университета, разработанный специально для больных с ХСН.
Прогноз. Годичная смертность больных ХСН I функционального класса по классификации Нью-Йоркской ассоциации сердца (ФК NYHA) составляет около 10%, при II ФК — 20%, при III ФК — 40%, при IV ФК — более 60%. Несмотря на внедрение новых методов терапии уровень смертности больных с ХСН не снижается.
Лечение ХСН.
Целями лечения ХСН являются устранение или минимизация клинических симптомов ХСН — повышенной утомляемости, сердцебиения, одышки, отеков; защита органов-мишеней — сосудов, сердца, почек, головного мозга (по аналогии с терапией АГ), а также предупреждение развития гипотрофии поперечно-полосатой мускулатуры; улучшение качества жизни, увеличение продолжительности жизни уменьшение количества госпитализаций.
Существуют немедикаментозные и медикаментозные методы лечения.
Немедикаментозные методы
Диета. Главный принцип — ограничение потребления соли и в меньшей степени — жидкости.
При любой стадии ХСН больной должен принимать не менее 750 мл жидкости в сутки.
Ограничения по употреблению соли для больных ХСН 1 ФК — менее 3 г в сут, для больных II—III ФК — 1,2—1,8 г в сут, для IV ФК — менее 1 г в сут.
Физическая реабилитация. Варианты — ходьба или велотренажер по 20-30 мин в день до пяти раз в неделю с осуществлением самоконтроля самочувствия, пульса (эффективной считается нагрузка при достижении 75—80% от максимальной для пациента ЧСС).
Медикаментозное лечение ХСН.
Весь перечень лекарственных средств, применяемых для лечения ХСН, подразделяют на три группы: основная, дополнительная, вспомогательная.
Основная группа препаратов полностью соответствует критериям «медицины доказательств» и рекомендована к применению во всех странах мира: ингибиторы АПФ, мочегонные средства, СГ, b-адреноблокаторы (дополнительно к иАПФ).
Дополнительная группа, эффективность и безопасность которой доказана крупными исследованиями, однако требует уточнения (проведения мета-анализа): антагонисты альдостерона, антагонисты рецепторов к А-Н, БКК последнего поколения.
Вспомогательные препараты: применение их диктуется определенными клиническими ситуациями. К ним относятся периферические вазодилататоры, антиаритмические средства, антиагреuанты, прямые антикоагулянты, негликозидные положительные инотропные средства, кортикостероиды, статины.
Несмотря на большой выбор лекарственных средств в лечении больных недопустима полипрагмазия (неоправданное назначение большого количества групп препаратов).
В то же время сегодня на уровне поликлинического звена основная группа препаратов для лечения ХСН не всегда занимает ведущие позиции, порой отдается предпочтение препаратам второй и третьей групп.
Ниже приведена характеристика препаратов основной группы.
Ингибиторы АПФ. В России полностью доказана эффективность и безопасность в лечении ХСН следующих иАПФ: каптоприл, эналаприл, рамиприл, фозиноприл, трандолаприл.
Назначение иАПФ показано всем больным ХСН, вне зависимости от стадии, функционального класса, этиологии и характера процесса.
Неназначение иАПФ ведет к увеличению смертности больных с ХСН. Наиболее раннее назначение иАПФ, уже при I ФК ХСН, способно замедлить прогрессирование ХСН.
Ингибиторы АПФ можно назначать больным с ХСН при уровне АДс выше 85 мм рт. ст.
При исходно низком АД (85—100 мм рт. ст.) эффективность иАПФ сохраняется, поэтому их всегда и обязательно следует назначать, снижая стартовую дозу в два раза (для всех иАПФ).
Артериальная гипотензия может иметь место сразу после начала терапии иАПФ вследствие быстрого воздействия на циркулирующие нейрогормоны.
При терапии в титрующих дозах этот эффект либо не возникает, либо уменьшается максимум к концу второй недели терапии.
А длительный эффект иАПФ реализуется через блокаду тканевых нейрогормонов.
Минимизация артериальной гипотензии достигается отказом от одновременного назначения иАПФ и вазодилататоров b-адреноблокаторов, БКК, нитратов), после стабилизации уровня АД при необходимости можно вернуться на прежнюю терапию; отказом от предшествующей активной мочегонной терапии, особенно накануне с целью избежать потенцирующего эффекта препаратов.
У пациентов с исходной гипотензией возможно кратковременное применение небольших доз стероидных гормонов — 10—15 мг/сут, однако, если исходное систолическое артериальное давление (АДс) менее 85 мм рт. ст., терапия иАПФ не показана.
Начало терапии любым иАПФ следует начинать с минимальных (стартовых) доз, которые рассмотрены ниже.
Возможными побочными реакциями, помимо артериальной гипотензии, при назначении иАПФ (в сумме не более 7—9% причин отмены) являются: сухой кашель, нарастание степени ХПН в виде азотемии, гиперкалиемии.
Сухой кашель, возникающий примерно в 3% случаев, обусловлен блокадой разрушения брадикинина в бронхах.
Доказана возможность назначения иАПФ при наличии хронического бронхита или бронхиальной астмы, при этом степень кашля не усиливается.
Наименьший риск данного побочного действия имеет фозиноприл.
При снижении клубочковой фильтрации ниже 60 мл/мин дозы всех иАПФ должны быть уменьшены вдвое, а при снижении ниже 30 мл/мин на 3/4. Это же относится и к лечению пожилых больных с ХСН, у которых почечная функция, как правило, нарушена.
Исключением является фозиноприл, дозу которого не нужно адаптировать при почечной недостаточности и у пожилых больных, так как он имеет два пути выведения из организма — почки и желудочно-кишечный тракт.
Сбалансированный двойной путь выведения из организма имеет и спираприл, что также позволяет рекомендовать его больным с почечной недостаточностью/
Основные принципы дозирования иАПФ. Существует понятие стартовых и максимальных (целевых) доз для каждого конкретного препарата. Удвоение дозы препарата производится не чаще, чем 1 раз в нед (титрование), при условии хорошего самочувствия пациента, отсутствии побочных реакций, а также уровне АДс не менее 90 мм рт. ст.
Антагонисты рецепторов к АН (кандесартан) — могут применяться наряду с иАПФ в качестве средства первой линии для блокады РААС у больных с клинически выраженной декомпенсацией.
Не теряют своей эффективности у женщин (в отличие от иАПФ).
В то же время не доказан профилактический эффект по предотвращению симптомной ХСН и отсутствует эффективность при ХСН с сохраненной систолической функцией ЛЖ, когда сохраняется эффективность иАПФ.
Способность предотвращать развитие ХСН у пациентов с диабетической нефропатией доказана для другого представителя класса антагонистов рецепторов к ангиотензину II (АрАТП) — лосартана.
Антагонисты альдостерона (спиронолактон) успешно применяются в комплексной диуретической терапии тяжелой ХСН как калийсберегающий диуретик с середины 60-х гг.
Показанием к такому использованию препарата является наличие декомпенсированной ХСН, гиперидратации и необходимости лечения активными диуретиками. Именно в качестве надежного партнера тиазидных и петлевых диуретиков следует рассматривать назначение спиронолактона.
В период достижения компенсации (особенно у пациентов с ХСН III—IV ФК) применение спиронолактона абсолютно необходимо и можно не бояться сочетания его высоких доз с иАПФ или АрАТП, если параллельно правильно используются активные диуретики и достигается положительныйдиурез.
Однако после достижения состояния компенсации применение высоких доз спироналактона прекращается и рассматривается вопрос о длительном назначении невысоких доз препарата в качестве дополнительного нейрогормонального модулятора.
Не рекомендуется лишь сочетание больших доз спиронолактона и высоких доз иАПФ при длительном лечении ХСН. Для достижения состояния компенсации при обострении ХСН и гипергидратации такая комбинация, как уже сказано выше, показана, но требует тщательного контроля уровня калия и креатинина.
При обострении явлений декомпенсации спиронолактон используется в высоких дозах (100-300 мг, или 4-12 таблеток, назначаемых однократно утром или в два приема утром и в обед) на период 1—3 нед до достижения компенсации.
После этого доза должна быть уменьшена.
Критериями эффективности применения спиронолактона в комплексном лечении упорного отечного синдрома являются: увеличение диуреза в пределах 20-25%; уменьшение жажды, сухости во рту и исчезновение специфического «печеночного» запаха изо рта; стабильная концентрация калия и магния в плазме (отсутствие снижения) несмотря на достижение положительного диуреза.
В дальнейшем для длительного лечения больных с выраженной декомпенсацией III—IV ФК рекомендуется использование малых (25-50 мг) доз спиронолактона дополнительно к иАПФ и БАБ в качестве нейрогуморального модулятора, позволяющего более полно блокировать РААС, улучшать течение и прогноз больных с ХСН.
Концентрация спиронолактона в плазме крови выходит на плато к третьему дню лечения, и после отмены (или уменьшения дозы препарата) его концентрация и действие пропадают (снижаются) через трое суток.
Из основанных побочных реакций спиронолактона (кроме возможной гиперкалиемии и нарастания уровня креатинина) следует отметить развитие гинекомастии (до 10% пациентов).
При наличии повышенного уровня креатинина сыворотки (> 130 мкмол/л), почечной недостаточности в анамнезе, гиперкалиемии, причем даже умеренной (>5,2 мкмоль/л), сочетание антагонистов альдостерона с иАПФ требует тщательного клинического и лабораторного контроля.
Мочегонные средства (диуретики).
Основное показание для назначения мочегонных препаратов — клинические признаки и симптомы избыточной задержки жидкости в организме больного ХСН. Однако следует помнить о том, что диуретики обладают двумя негативными свойствами — гиперактивируют нейрогормоны ренин-ангиотензин-альдостероновой системы, а также вызывают электролитные нарушения.
Принципы терапии диуретиками:
— комбинируются с иАПФ, что позволяет снизить дозу мочегонных средств при одинаковом клиническом эффекте;
— назначается слабейший из эффективных диуретиков с целью предотвращения развития зависимости пациента от мочегонных средств, а также для возможности иметь резерв по типу и дозе диуретика в период декомпенсации ХСН;
— назначаются ежедневно в минимальной дозе с достижением положительного баланса жидкости по диурезу в фазу терапии декомпенсации ХСН 800—1000 мл, при поддерживающей терапии — 200 мл под контролем массы тела.
Характеристика наиболее часто используемых диуретиков.
В настоящее время в основном применяются две группы диуретиков — тиазидные и петлевые.
Из группы тиазидных диуретиков предпочтение отдается гидрохлортиазиду, который назначается при умеренной ХСН (II—III ФК NYHA). В дозе до 25 мг в сут вызывает минимум побочных реакций, в дозе более 75 мг могут регистрироваться дисэлектролитные расстройства.
Максимальный эффект — через 1 ч после приема, длительность действия — 12 ч.
Рекомендован прием утром натощак.
Один из наиболее мощных петлевых диуретиков — фуросемид, начальный эффект — через 15—30 мин, максимальный эффект — через 1-2 ч, продолжительность действия — 6 ч.
Диуретический эффект сохраняется также при сниженной функции почек. Доза варьирует от степени выраженности симптомов ХСН — от 20 до 500 мг в сут.
Рекомендован прием утром натощак.
Этакриновая кислота — препарат, похожий на фуросемид, однако из-за действия на разные ферментативные системы петли Генле может применяться при развитии рефрактерности к фуросемиду, либо комбинироваться с ним при упорных отеках.
Дозировка — 50-100 мг в сут, максимальная доза — 200 мг.
Рекомендован прием утром натощак.
Дегидратационная терапия при ХСН имеет две фазы — активную и поддерживающую.
В активной фазе превышение выделенной мочи над принятой жидкостью должно составлять 1—2л в сут, при снижении веса ежедневно
по 1 кг. Никакая стремительная дегидратация не может быть оправданной и лишь приводит к гиперактивации нейрогормонов и рикошетной задержке жидкости в организме.
В поддерживающей фазе диурез должен быть сбалансированным и масса тела стабильной при регулярном (ежедневном) назначении мочегонных.
Наиболее частая ошибка в назначении диуретиков в России — попытка «ударного» диуреза (один раз в несколько дней).
Более ошибочной тактики лечения, как с учетом качества жизни пациента, так и прогрессирования ХСН, трудно представить.
Алгоритм назначения диуретиков (в зависимости от тяжести ХСН) представляется следующим:
IФК — не лечить мочегонными,
II ФК (без застоя) — не лечить мочегонными,
II ФК (застой) — тиазидные диуретики, только при их неэффективности можно назначать петлевые мочегонные,
III ФК (декомпенсация) — петлевые (тиазидные) + антагонисты альдостерона, в дозах 100-300 мг/сут,
III ФК (поддерживающее лечение) — тиазидные (петлевые) + спиронолактон (малые дозы) + ацетазоламид (по 0,25 х 3 раза/сут в течение 3—4 дней, раз в 2 нед),
IV ФК — петлевые + тиазидные (иногда сочетание двух петлевых диуретиков фуросемида и урегита) + антагонисты альдостерона + ингибиторы карбоангидразы (ацетазоламид по 0,25 х 3 раза/сут в течение 3—4 дней, раз в 2 нед).
При рефрактерном отечном синдроме существуют следующие приемы преодоления устойчивости к использованию мочегонных средств:
— применение диуретиков только на фоне иАПФ и спиронолактона;
— введение большей (вдвое большей, чем предыдущая неэффективная доза) дозы диуретика и только в/в (некоторые авторы предлагают вводить фуросемид (лазикс) дважды в сутки и даже постоянно в/в капельно);
— сочетание диуретиков с препаратами, улучшающими фильтрацию (при АДс более 100 мм рт. ст.
— эуфиллин 10 мл 2,4% раствора в/в капельно и сразу после капельницы — лазикс или СГ, при более низком АД — допамин 2-5 мкг/мин);
— применение диуретиков с альбумином или плазмой (можно вместе, что особенно важно при гипопротеинемии, но эффективно и у пациентов с нормальным уровнем белка плазмы);
— при выраженной гипотонии — комбинация с положительными инотропными средствами (добутамин, допамин) и, в крайнем случае, с глюкокортикоидами (только на период критической гипотонии);
— сочетание диуретиков по тем принципам, что указаны выше; механические способы удаления жидкости (плевральная, перикардиальная пункции, парацентез) — используются лишь по витальным показаниям; изолированная ультрафильтрация (противопоказания — стенозы клапанных отверстий, низкий сердечный выброс и гипотония).
Сердечные гликозиды.
В настоящее время наиболее распространенный сердечный гликозид в России — дигоксин, единственный препарат из группы положительных инотропных средств, остающийся в широкой клинической практике при длительном лечении ХСН.
Негликозидные средства, повышающие сократимость миокарда, негативно влияют на прогноз и длительность жизни пациентов и могут применяться в виде коротких курсов при декомпенсации ХСН.
Эффект СГ в настоящее время связывают не столько с их положительным инотропным действием, сколько с отрицательным хронотропным влиянием на миокард, а также с воздействием на уровень нейрогормонов, как циркулирующих, так и тканевых, а также с модулированием барорефлекса.
Исходя из вышеописанных характеристик дигоксин является препаратом первой линии у больных с ХСН при наличии постоянной тахисистолической формы МА.
При синусовом ритме отрицательный хронотропный эффект дигоксина слаб, а потребление миокардом кислорода значительно возрастает вследствие положительного инотропного действия, что приводит к гипоксии миокарда.
Таким образом, возможно провоцирование различных нарушений ритма, особенно у пациентов с ишемической этиологией ХСН.
Итак, оптимальные показания для назначения СГ следующие: постоянная тахисистолическая форма МА; выраженная ХСН (III-IV функциональный класс NYHA); фракция выброса менее 25%; кардиоторакальный индекс более 55%; неишемическая этиология ХСН (ДКМП и т. д,).
Принципы лечения в настоящее время: назначение небольших доз СГ (дигоксин не более 0,25 мг в сут) и, что желательно, но проблематично в общероссийской практике — под контролем концентрации дигоксина в плазме крови (не более 1,2 нг/мл).
При назначении дигоксина необходимо учитывать его фармакодинамику — концентрация в плазме экспоненциально увеличивается к восьмому дню от начала терапии, поэтому таким больным в идеале показано выполнение суточного мониторирования ЭКГ с целью контроля за нарушениями ритма.
Мета-анализ исследований по дигоксину, проведенных по правилам доказательной медицины, показал, что гликозиды улучшают качество жизни (через уменьшение симптомов ХСН); снижается число госпитализаций, связанных с обострением ХСН; однако дигоксин не влияет на прогноз у больных.
b-адреноблокаторы.
В 1999 г. в США и странах Европы, а теперь и в России b-адреноблокаторы рекомендованы к использованию в качестве основных средств для лечения ХСН.
Таким образом, был опровергнут постулат о невозможности назначения больным с ХСН препаратов, обладающих отрицательным инотропным действием.
Доказана эффективность следующих препаратов:
— карведилол — обладает, наряду b-блокирующей активностью, антипролиферативным и антиоксидантным свойствами;
— бисопролол — наиболее избирательный в отношении b1-рецепторов селективный b-адреноблокатор;
— метопролол (ретардная форма с медленным высвобождением) — селективный липофильный b-адреноблокатор.
Принципы терапии b-адреноблокаторами.
Перед назначением b-адреноблокаторов необходимо выполнение следующих условий:
— пациент должен находится на отрегулированной и стабильной дозе иАПФ, не вызывающей артериальной гипотензии;
— необходимо усилить диуретическую терапию, так как из-за временного краткосрочного снижения насосной функции возможно обострение симптомов ХСН;
— по возможности отменить вазодилататоры, особенно нитропрепараты, при гипотонии возможен короткий курс кортикостероидной терапии (до 30 мг в сутки перорально);
— стартовая доза любого b-адреноблокатора при лечении ХСН — 1/8 средней терапевтической: 3,125 мг— для карведилола; 1,25 — для бисопролола; 12,5 — для метопролола; удвоение дозировок b-адреноблокаторов не чаще, чем 1 раз в две недели, при условии стабильного состояния больного, отсутствии брадикардии и гипотонии;
достижение целевых доз: для карведилола — по 25 м г два раза в сутки, для бисопролола — 10 мг в сутки однократно (либо по 5 мг два раза), для метопролола медленного высвобождения — 200 мг в сут.
Принципы сочетанного применения основных средств для лечения ХСН,
Монотерапия при лечении ХСН применяется редко, и в этом качестве могут быть использованы только иАПФ при начальных стадиях ХСН.
Двойная терапия иАПФ + диуретик — оптимально подходит для пациентов с ХСН II—III ФК NYHA с синусовым ритмом;
схема диуретик + гликозид, чрезвычайно популярная в 50-60-е гг., в настоящее время не применяется.
Тройная терапия (иАПФ + диуретик + гликозид) — была стандартом в лечении ХСН в 80-х гг. и сейчас остается действенной схемой влечении ХСН, однако дая пациентов с синусовым ритмом рекомендуется замена гликозида на b-адреноблокатор.
Золотой стандарт с начала 90-х годов по настоящее время — комбинация четырех препаратов: иАПФ + диуретик + гликозид + b-адреноблокатор.
Эффект и влияние вспомогательных средств на прогноз больных с ХСН не известны (не доказаны), что соответствует уровню доказательности С. Собственно, этими препаратами не нужно (да и невозможно) лечить саму ХСН, а их применение диктуется определенными клиническими ситуациями, осложняющими течение собственно декомпенсации:
• периферические вазодилататоры (ПВД) = (нитраты), применяемые при сопутствующей стенокардии;
• блокаторы медленных кальциевых каналов (БМКК) — длительнодействуюшие дигидроперидины при упорной стенокардии и стойкой АГ;
• антиаритмические средства (кроме БАБ, входящих в число основных препаратов, в основном III класса) при опасных для жизни желудочковых аритмиях;
• аспирин (и другие антиагреганты) для вторичной профилактики после перенесенного ИМ;
• негликозидные инотропные стимуляторы — при обострении ХСН, протекающей с низким сердечным выбросом и упорной гипотонией.
Источник: ruslekar.com
Инновационная стратегия в терапии сердечной недостаточности Текст научной статьи по специальности «Медицина и здравоохранение»
Аннотация научной статьи по медицине и здравоохранению, автор научной работы — Джаиани Н. А.
Статья посвящена инновационному препарату для лечения хронической сердечной недостаточности – комбинации ингибитора неприлизина сакубитрила и антагониста рецепторов ангиотензина II первого типа валсартана (сакубитрил/ валсартан). Приведены результаты исследований, в которых сочетание сакубитрил/валсартан продемонстрировало эффективность у больных как с артериальной гипертензией, так и с сердечной недостаточностью . Показаны преимущества комбинации сакубитрил/валсартан по сравнению с другими препаратами, влияющими на компоненты ренин-ангиотензин-альдостероновой системы , с позиций безопасности и эффективности у больных с сердечной недостаточностью . The article is devoted to the innovative drug to treat chronic cardiac insufficiency – a combination of sakubitril neprilysin inhibitor and first type angiotension II receptor antagonist valsartan (sacubitril/valsartan). Study results are provided in which a combination of sacubitril/valsartan demonstrated effectiveness in patients with arterial hypertension as well as with cardiac insufficiency . Advantages of a combination of sacubitril/valsartan as compared to other drugs affecting components of rennin-angiotension-aldosteron system from the point of view of safety and effectiveness in patients with cardiac insufficiency are demonstrated.
Похожие темы научных работ по медицине и здравоохранению , автор научной работы — Джаиани Н. А.,
Текст научной работы на тему «Инновационная стратегия в терапии сердечной недостаточности»
Н.А. ДЖАИАНИ, д.м.н., профессор, Московский государственный медико-стоматологический университет им. А.И. Евдокимова Минздрава России
ИННОВАЦИОННАЯ СТРАТЕГИЯ В ТЕРАПИИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Статья посвящена инновационному препарату для лечения хронической сердечной недостаточности — комбинации ингибитора неприлизина сакубитрила и антагониста рецепторов ангиотензина II первого типа валсартана (сакубитрил/ валсартан). Приведены результаты исследований, в которых сочетание сакубитрил/валсартан продемонстрировало эффективность у больных как с артериальной гипертензией, так и с сердечной недостаточностью. Показаны преимущества комбинации сакубитрил/валсартан по сравнению с другими препаратами, влияющими на компоненты ренин-ангиотензин-альдостероновой системы, с позиций безопасности и эффективности у больных с сердечной недостаточностью.
Ключевые слова: сердечная недостаточность, ренин-ангиотензин-альдостероновая система, неприлизин, комбинация сакубитрил/валсартан.
N.A. JAIANI, MD, Prof.
Evdokimov Moscow State Medical and Stomatologic University of the Ministry of Health of Russia INNOVATIVE STRATEGY IN THERAPY OF CARDIAC INSUFFICIENCY
The article is devoted to the innovative drug to treat chronic cardiac insufficiency — a combination of sakubitril neprilysin inhibitor and first type angiotension II receptor antagonist valsartan (sacubitril/valsartan). Study results are provided in which a combination of sacubitril/valsartan demonstrated effectiveness in patients with arterial hypertension as well as with cardiac insufficiency. Advantages of a combination of sacubitril/valsartan as compared to other drugs affecting components of rennin-angiotension-aldosteron system from the point of view of safety and effectiveness in patients with cardiac insufficiency are demonstrated.
Keywords: cardiac insufficiency, rennin-angiotensin-aldosteron system, neprilysin, combination sacubitril/valsartan.
Компонентом эффективной терапии, снижающей сердечно-сосудистую смертность и улучшающей прогноз больных с сердечной недостаточностью (СН), являются препараты, подавляющие активность ренин-ангиотензин-альдостероновой системы (РААС), оказывающей значимое влияние на патогенез СН. В настоящее время в данной терапии фокус смещается на систему деградации натрийуретических пептидов (НУП). Ферментом, способствующим деградации натрий-уретического пептида, является нейтральная эндопепти-даза (НЭП) [1]. НЭП широко представлены в эндотелиаль-ных и гладкомышечных клетках, кардиомиоцитах, эпителиальных клетках почечных канальцев, а также в фибро-бластах, устойчиво обнаруживаются в легочной ткани, головном мозге, сердце и кишечнике. НЭП участвуют в инактивации не только НУП, но и таких эндогенных вазо-активных пептидов, как брадикинин и адреномедуллин, а также эндотелин-1 и ангиотензин II (АТ II). Установлено, что селективные ингибиторы НЭП предотвращают деградацию НУП in vitro и in vivo, а также повышают их биологическую активность. Кроме того, ингибиторы НЭП способны увеличивать энзиматическую конверсию большого эндотелина (big endotheLin) в активную форму -эндотелин-1 [2].
Неприлизин представляет собой НЭП, которая разрушает несколько эндогенных вазоактивных пептидов,
включая НУП, брадикинин и адреномедуллин 4. При СН повышенное содержание эндотелина, аргинин-вазо-прессина и катехоламинов способствует стимулированию синтеза и высвобождения НУП. Как известно, НУП обладают защитными свойствами в отношении сердечно-сосудистой системы [1]. НУП снижают активность РААС, тормозят пролиферативные процессы [6, 7], способствуют блокированию высвобождения альдостерона, обладают натрийуретическим эффектом и снижают тонус сосудов [8, 9].
К НУП относят предсердный натрийуретический пептид (ПНУП), мозговой натрийуретический пептид (МНУП) и эндотелиальный натрийуретический пептид типа С (СНУП) [10, 11]. ПНУП и МНУП образуются в основном в кардиомиоцитах. Пусковым механизмом для синтеза ПНУП и ВНУП является повышение напряжения миокар-диальной стенки 12. СНУП образуется в клетках эндотелия и почечных канальцев. ПНУП выделяется кар-диомиоцитами в виде активного гормона, а МНУП — как прогормон (ргс^Р1-108) [15]. ПНУП и МНУП снижают тонус симпатической нервной системы, усиливают проницаемость вен, вызывая перемещение жидкой части плазмы во внесосудистое пространство. МНУП действует на проксимальные и дистальные канальцы нефрона, при этом максимальный натрийуретический эффект осуществляется на уровне дистальных отделов нефрона [16].
Триггером для синтеза ШУП клетками эндотелия является выброс цитокинов и эндотелий-зависимых аго-нистов (ацетилхолин) 19. Для ШУП также характерны выраженные кардиовазальные эффекты: снижение сердечного выброса, уменьшение давления наполнения левого желудочка, вазодилатация. При этом воздействие на почки у СНУП минимальное [11, 18]. Однако у СНУП наиболее выраженный антифиброзный эффект по сравнению с другими НУП.
Таким образом, кардиопротективные свойства НУП при СН крайне важны. Показано, что при артериальной гипертонии (АГ) наблюдается дефицит НУП, приводящий к нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) также наблюдается дисбаланс гормонов системы НУП 24. Поэтому синтез ингибиторов НЭП — значимый шаг в фармакотерапии сердечнососудистых заболеваний, в частности СН. В ранее проведенных исследованиях изучалась комбинация ингибитора НЭП с ингибитором ангиотензинпревращающего фермента (АПФ). Несомненно, блокада синтеза АТ II, обладающего выраженным сосудосуживающим, пролифератив-ным действием, активирующим симпато-адреналовую систему, способствующего задержке натрия, — главный механизм действия ингибиторов АПФ, являющихся стандартом в терапии СН 30.
Установлено, что селективные ингибиторы НЭП предотвращают деградацию НУП in vitro и in vivo, а также повышают их биологическую активность
Сравнение эффективности комбинированного препарата омапатрилата (ингибитора АПФ / ингибитора НЭП) и ингибиторов АПФ проводилось в нескольких многоцентровых исследованиях. В исследовании IMPRESS (Comparison of vasopeptidase inhibitor, omapatriLat, and LisinopriL on exercise toLerance and morbidity in patients with heart faiLure: IMPRESS randomised triaL) [32], в котором принимали участие 573 пациента с ХСН (NYHA II-IV, фракцией выброса (ФВ) 140 мм рт. ст. и ХСН был продемонстрирован хороший терапевтический эффект, но в группе пациентов с исходным АД 40%) гипотензивных состояний и головокружений.
Таким образом, оба клинических исследования засвидетельствовали некую позитивную тенденцию, но не показали каких-либо значительных преимуществ над ингибиторами АПФ.
Крупномасштабное исследование OCTAVE (Omapa-triLat and enaLapriL in patients with hypertension: the OmapatriLat Cardiovascular Treatment vs. EnaLapriL (OCTAVE) triaL) [34], проводимое у 25 302 больных АГ, показало более выраженное снижение систолического АД у пациентов в группе омапатрилата по сравнению с контрольной группой принимающих эналаприл. Кашель с одинаковой частотой регистрировался в обеих группах, однако случаи ангионевротического отека чаще отмечались в группе лечения омапатрилатом (2,17% по сравнению с 0,68% в контрольной группе).
Со времени публикации результатов указанных испытаний значимым прорывом в кардиологии явились итоги исследования другой комбинации с ингибитором НЭП -препарата, содержащего ингибитор неприлизина саку-битрил и антагонист АТ II первого типа валсартан (комбинация сакубитрил/валсартан). Как известно, блокаторы рецепторов АТ (БРА) II первого типа являются альтернативой ингибиторам АПФ по данным результатов крупномасштабных исследований 37. БРА II не влияют на метаболизм кининов в отличие от ингибиторов АПФ, поэтому потенциально имеют меньший риск развития ангионевротических осложнений. Комбинированный препарат LCZ696, состоящий из ингибитора неприлизина сакубитрила (AHU377) и БРА валсартана, был разработан для минимизации риска развития тяжелого ангионевро-тического отека [38, 39].
Триггером для синтеза СНУП клетками эндотелия является выброс цитокинов и эндотелий-зависимых агонистов (ацетилхолин). Для СНУП также характерны выраженные кардиовазальные эффекты: снижение сердечного выброса, уменьшение давления наполнения левого желудочка, вазодилатация
Сочетание сакубитрил/валсартан продемонстрировало эффективность у больных как с АГ, так и с СН. В крупном исследовании у больных АГ (n = 1328) препарат в дозах 200-400 мг показал преимущество в гипотензивном эффекте перед валсартаном в дозах 160-320 мг в виде дополнительного снижения АД на 5/3 и 6/3 мм рт. ст. [40]. Гипотензивный эффект комбинации сакубитрил/ валсартан сопровождался более выраженным снижением
пульсового АД: на 2,25 и 3,32 мм рт. ст. соответственно в дозах 200 и 400 мг, что в настоящее время рассматривается как положительный прогностический фактор по влиянию на жесткость сосудистой стенки и сердечнососудистые исходы. Переносимость у больных АГ была хорошей, случаев ангионевротического отека не было отмечено. В исследовании PARAMOUNT сравнивали сакубитрил/валсартан с группой валсартана у 685 пациентов с ХСН II — IV функциональных классов (ФК) (NYHA) и сохраненной ФВ (45% и более) [41]. Сакубитрил/валсартан титровали до 200 мг 2 р/сут, а валсартан — до 160 мг 2 р/сут. Новый препарат обеспечивал существенное снижение уровня прогормона МНУП — NT-proBNP (первичная конечная точка) через 12 нед. (605 пг/мл против 835 мг/мл у получавших валсартан, р = 0,005), но не через 36 нед. терапии (р = 0,20), уменьшал объем левого предсердия, ФК ХСН, хорошо переносился больными.
Несомненно, блокада синтеза АТ II, обладающего выраженным сосудосуживающим, пролиферативным действием, активирующим симпато-адреналовую систему, способствующего задержке, натрия, — главный механизм действия ингибиторов АПФ, являющихся стандартом в терапии СН
Три года назад на конгрессе Европейского общества кардиологов были обнародованы результаты исследования PARADIGM-HF (Prospective Comparison of ARNI (Angiotensin Receptor-NepriLysin Inhibitor) with ACEI (Angiotensin-Converting-Enzyme Inhibitor) to Determine Impact on GLobaL Mortality and Morbidity in Heart Failure TriaL) [42], которые стали значимыми в области лечения ХСН. PARADIGM-HF представляло собой международное многоцентровое двойное слепое плацебо-контролируе-мое исследование с параллельными группами (III фаза), изучавшее эффективность и безопасность комбинации сакубитрил/валсартан в сравнении с популярным ингибитором АПФ эналаприлом. При проведении исследования предполагалось проверить гипотезу о том, что применение комбинации сакубитрил/валсартан по сравнению с приемом ингибитора АПФ эналаприла будет более эффективно влиять на частоту развития осложнений и смертность больных с ХСН. Следует отметить, что PARADIGM-HF — это первое современное исследование в области СН, в котором предлагалась замена одного из основных элементов лечения таких пациентов, т. е. ингибитора АПФ.
В общей сложности в исследование PARADIGM-HF было включено 8436 пациентов в возрасте 18 лет или старше с СН, соответствующей II, III или IV ФК (NYHA), на фоне сниженной ФВ левого желудочка (40% или менее) (у большинства пациентов был II-III класс СН). Кроме того, для включения в исследование уровень МНУП должен был составлять не менее 150 пкг/мл (или N-концевого предшественника МНУП не менее 600 пкг/мл); в случае госпитализации по поводу утяжеления СН в течение предшествующих 12 мес. МНУП должен был быть не менее
100 пкг/мл (или N-концевого предшественника МНУП не менее 400 пкг/мл). В исследование можно было включать больных, принимавших в течение не менее 4 нед. стабильную дозу бета-блокатора и ингибитора АПФ (или БРА), которая должна была быть эквивалентной не менее чем 10 мг эналаприла. С использованием двойного слепого метода рандомизации больных распределяли в соотношении 1:1 в группу приема эналаприла (по 10 мг 2 р/сут) или комбинации сакубитрил/валсартан (по 200 мг 2 р/сут). Первичной конечной точкой была комбинация смерти от сердечно-сосудистых причин или госпитализации по поводу СН, но исследование было спланировано таким образом, чтобы его мощность была также достаточна для выявления различий между показателями смертности от сердечно-сосудистых причин. В ходе исследования тщательно контролировались данные о случаях развития артериальной гипотонии, ухудшения функции почек, гиперкалиемии, кашля или ангионевротического отека. Медиана продолжительности наблюдения составила 27 мес. Исследование PARADIGM-HF было остановлено намного ранее запланированной даты ввиду того, что были получены статистически достоверные цифры в отношении влияния исследуемого препарата на первичные конечные точки: снижение сердечно-сосудистой смертности и комбинированного показателя «сердечно-сосудистая смертность + госпитализация по поводу декомпенсации СН». На момент остановки исследования первичная конечная точка была зафиксирована у 914 пациентов (21,8%) в группе сакубитрил/валсартан и у 1117 пациентов (26,5%) в группе эналаприла (ОР для группы LCZ696 составило 0,80; 95% ДИ, 0,73-0,87; p 5,5 ммоль/л) и тяжелой гиперкалиемии (уровень калия
> 6,0 ммоль/л) у пациентов, получавших или не получавших АМР исходно, а также риска развития гиперкалиемии у тех, кто начал лечение АМР недавно. Результаты показали, что по сравнению с 3728 пациентами (21,6% женщин), которые не получали лечение АМР вначале, принимающие АМР исходно пациенты (4671 человек, 22,0% женщин), как правило, были моложе, с более низкими ФВ левого желудочка, систолическим АД, а также с более выраженными симптомами СН. Среди тех, кто принимал АМР исходно, уровень гиперкалиемии был схожим у пациентов обеих групп лечения, однако тяжелая гиперкалиемия чаще встречалась у пациентов группы эналаприла, нежели у пациентов, принимающих сакубитрил/валсартан (3,1 против 2,2 на 100 человеко-лет; ОР 1,37; 95% ДИ 1,06-1,76; p = 0,02). В анализах пациентов, которые начали принимать АМР недавно, тяжелая гиперкалиемия также чаще встречалась у пациентов, случайным образом распределенных в группу эналаприла, чем у пациентов группы сакубитрил/валсартан (3,3 против 2,3 на 100 человеко-лет; ОР 1,43; 95% ДИ 1,13-1,81; р = 0,003). Следовательно, среди пациентов с симптомами СН со сниженной ФВ, принимающих АМР, тяжелая гипер-калиемия чаще наблюдалась во время лечения энала-прилом, чем во время лечения комбинацией сакубитрил/ валсартан. Эти данные свидетельствуют о том, что комбинация АМР + сакубитрил/валсартан по сравнению с ком-
бинацией АМР + эналаприл оказывается более безопасной в плане риска развития гиперкалиемии.
Согласно последним данным, система НУП участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома [11]. Внушительные результаты получены в процессе субанализа данных исследования PARADIGM-HF касательно влияния сакубитрила/ валсартана и эналаприла на гликемический контроль, в частности, на гликозилированный гемоглобин (НЬА1С), а также на время первого применения инсулина или пер-оральных гипогликемических препаратов у пациентов с сахарным диабетом (СД) и СН со сниженной ФВ [47]. Бесспорно, СД является независимым фактором риска прогрессирования СН. В анализ были включены 3778 пациентов с известным СД или обнаруженным НЬА1с £ 6,5% во время скрининга. Время первого применения пероральных гипогликемических препаратов или инсулина у пациентов, ранее не получавших данные препараты, сравнивали между группами лечения. Результаты показали, что не было отмечено достоверных различий в концентрациях НЬА1с между рандомизированными группами при скрининге.
При приеме внутрь комплекс сакубитрил/ валсартан распадается на сакубитрил, который затем метаболизируется с образованием метаболита 130657, и валсартан; концентрации названных веществ в плазме крови достигают максимума через 0,5, 3 и 1,5 ч соответственно
В течение 1-го года наблюдения уровни НЬА1с уменьшились на 0,16% в группе эналаприла и на 0,26% в группе сакубитрил/валсартан (межгрупповое снижение 0,13%, 95% ДИ 0,05-0,22, р = 0,0023). Уровень НЬА1с в группе сакубитрил/валсартан был достоверно ниже, чем в группе эналаприла в течение 3-летнего периода наблюдения (межгрупповое снижение составило 0,14%, 95% ДИ 0,06-0,23, р = 0,0055). Первое применение инсулина происходило на 29% реже у пациентов, получавших сакубитрил/валсартан (114 (7%) пациентов), по сравнению с пациентами, получавшими эналаприл (153 (10%) (ОР 0,71; 95% ДИ 0,56-0,90; р = 0,0052). Аналогичным образом в группе сакубитрил/валсартан меньше пациентов начали принимать пероральные гипогликемические препараты (ОР 0,77; ДИ 0,58-1,02; р = 0,073). Следовательно, в исследовании PARADIGM-HF пациенты с СД и СН со сниженной ФВ, которые получали сакубитрил/валсартан, имели более выраженное долгосрочное снижение НЬА1с по сравнению с пациентами, получавшими эналаприл. Эти данные свидетельствуют о том, что комбинация сакубитрил/валсартан может усилить гликемический контроль у пациентов с СД и СН со сниженной ФВ.
С учетом результатов исследования PARADIGM-HF в 2015 г. комбинация сакубитрил/валсартан была одобрена Администрацией по контролю за продуктами и лекарствами США (FDA) и Европейским агентством по лекарственным средствам для лечения пациентов, страдающих ХСН-НФВ II — IV ФК по NYHA, и включена в рекомендации 2016 г. Европейского кардиологического общества в качестве средства лечения пациентов с ХСН [46, 48, 49].
При приеме внутрь комплекс сакубитрил/валсартан распадается на сакубитрил, который затем метаболизируется с образованием метаболита LBQ657, и валсартан; концентрации названных веществ в плазме крови достигают максимума через 0,5, 3 и 1,5 ч соответственно [50]. Применение препарата не зависит от времени приема пищи. Комплекс сакубитрила и валсартана в значительной степени связывается с белками плазмы крови (9497%). LBQ657 в небольшой степени проникает через ГЭБ (0,28%). LBQ657 далее существенно не метаболизируется. Валсартан метаболизируется в незначительной степени. После приема внутрь 52-68% сакубитрила (главным образом в виде LBQ657) и около 13% валсартана и его метаболитов выводятся почками, 37-48% сакубитрила (главным образом в виде LBQ657) и 86% валсартана и его метаболитов выводятся через кишечник. С учетом фармакокинетических данных у пациентов старше 65 лет коррекции дозы не требуется. У больных с нарушениями функции почек легкой и умеренной степени корректировать дозу не требуется. При нарушениях функции почек тяжелой степени сакубитрил/валсартан применяют с осторожностью. У пациентов с нарушениями функции печени легкой или умеренной степени, включая пациентов с обструкцией желчных путей, дозу корректировать не требуется. При тяжелых нарушениях функции печени препарат не рекомендован.
Сакубитрил/валсартан противопоказан к применению одновременно с ингибиторами АПФ, поскольку подавление неприлизина одновременно с применением ингибитора АПФ может увеличивать риск развития ангионевротического отека.
Противопоказаниями для назначения препарата являются повышенная чувствительность к сакубитрилу или к валсартану; одновременное применение с ингибиторами АПФ, а также период 36 ч после отмены ингибиторов АПФ; наличие ангионевротического отека в анамнезе на фоне предшествующей терапии ингибиторами АПФ или АРА II; одновременное применение с али-скиреном у пациентов с СД или у пациентов с умеренным или тяжелым нарушением функции почек (рСКФ
Свидетельство о регистрации СМИ Эл № ФС77-52970
Источник: cyberleninka.ru
Хроническая сердечная недостаточность лечение
Хроническая сердечная недостаточность — лечение
При лечении сердечной недостаточности необходимо в первую очередь оценить возможность воздействия на её причину. В ряде случаев эффективное этиологическое воздействие (например, хирургическая коррекция порока сердца, реваскуляризация миокарда при ИБС) может значительно уменьшить выраженность проявлении хронической сердечной недостаточности.
В лечении хронической сердечной недостаточности выделяют немедикаментозные и лекарственные методы терапии. Следует отметить, что оба вида лечения должны дополнять друг друга.
Хроническая сердечная недостаточность — лечение без операции
Немедикаментозное лечение сердечной недостаточности включает ограничение употребления поваренной соли до 5-6 г/сут, жидкости до 1-1,5 л/сут и оптимизацию физической активности. Умеренная физическая активность возможна (ходьба как минимум по 20-30 мин 3-5 раз в неделю). Полный физический покой следует соблюдать при ухудшении состояния (в покое снижается ЧСС и уменьшается работа сердца). Объём немедикаментозных мероприятий различен в зависимости от степени выраженности сердечной недостаточности.
Лекарства для лечения хронической недостаточности сердца
Конечная цель лечения хронической сердечной недостаточности — улучшение качества жизни и увеличение её продолжительности. Для достижения этой цели необходимы следующие мероприятия:
- Улучшение сократительной функции миокарда.
- Уменьшение ОЦК (снижение преднагрузки).
- Уменьшение ОПСС (снижение постнагрузки).
- Устранение влияния на сердце симпатической нервной системы.
- Антикоагулянтная терапия.
- Антиаритмическая терапия.
Из ЛС в лечении хронической сердечной недостаточности в зависимости от клинических проявлений заболевания применяют диуретики, ингибиторы АПФ, сердечные гликозиды, другие кардиотонические средства, вазодилатато-ры, /3-адреноблокаторы, антикоагулянты, антиаритмические средства.
Оптимальной комбинацией препаратов при выраженной сердечной недостаточности считают «тройную терапию»: диуретики, ингибиторы АПФ, сердечные гликозиды.
Диуретики при хронической сердечной недостаточности
При назначении диуретиков необходимо учитывать, что возникновение отёков при сердечной недостаточности связано с несколькими причинами (сужением почечных сосудов, увеличением секреции альдостерона, повышением венозного давления), лечение только диуретиками считают неадекватным. При хронической сердечной недостаточности обычно рекомендуют начинать лечение с петлевых (фуросемид) или тиазидных (например, гидрохлортиазид) диуретиков. При недостаточном диуретическом ответе комбинируют петлевые диуретики и тиазиды.
- Тиазидные диуретики. Обычно применяют гидрохлортиазид в дозе от 25 до 100 мг/сут. Следует помнить, что при скорости клубочковой фильтрации почек менее 30 мл/мин использовать тиазиды нецелесообразно.
- Петлевые диуретики начинают действовать быстрее, диуретический эффект у них выражен сильнее, но менее продолжителен, чем у тиазидных диуретиков. Применяют фуросемид в дозе 20-200 мг/сут в/в в зависимости от проявлений отёчного синдрома, диуреза. Возможно его назначение внутрь в дозе 40-100 мг/сут.
- Калийсберегающие диуретики (триамтерен, амилорид, комбинированный препарат триампур) дают более слабый мочегонный эффект, чем петлевые и тиазидные диуретики. Уменьшение активности альдостерона при применении спиронолактона благоприятно при хронической сердечной недостаточности.
Ингибиторы АПФ в лечении хронической недостаточности
Ингибиторы АПФ вызывают гемодинамическую разгрузку миокарда вследствие расширения сосудов, увеличения диуреза, уменьшения давления наполнения левого и правого желудочков. Показаниями для назначения ингибиторов АПФ считают клинические признаки сердечной недостаточности, снижение фракции выброса левого желудочка (менее 40%). При назначении ингибиторов АПФ необходимо соблюдать определённые условия по рекомендациям Европейского общества кардиологов (1997).
- Необходимо прекратить приём диуретиков за 24 ч до приёма ингибиторов АПФ.
- Следует проводить контроль АД до и после приёма ингибиторов АПФ.
- Лечение начинают с малых доз с постепенным их повышением.
- Необходимо контролировать функции почек (диурез, относительную плотность мочи) и концентрацию электролитов крови (ионов калия, натрия) при увеличении дозы каждые 3-5 дней, затем каждые 3 и 6 мес.
- Следует избегать совместного назначения калийсберегающих диуретиков (их можно назначать только при гипокалиемии).
- Нужно избегать сочетанного применения НПВС.
В настоящее время имеется большое количество ингибиторов АПФ, применяемых в лечении хронической сердечной недостаточности. Они различаются по длительности действия, кратности приёма и дозировкам.
Получены первые положительные данные о благоприятном влиянии блокаторов рецепторов ангиотензина II (в частности, лозартана) на течение хронической сердечной недостаточности как альтернативы ингибиторам АПФ при их непереносимости или противопоказаниях к назначению.
Сердечные гликозиды для медикаментозного лечения сердечной недостаточности
Сердечные гликозиды оказывают положительное инотропное (увеличивают и укорачивают систолу), отрицательное хронотропное (уменьшение ЧСС), отрицательное дромотропное (замедление АВ-проводимости) действие. Оптимальной поддерживающей дозой дигоксина считают 0,25-0,375 мг/сут (у пожилых пациентов 0,125-0,25 мг/сут); терапевтическая концентрация дигоксина в сыворотке крови составляет 0,5-1,5 мг/л. Дигоксин выводится почками в неизменённом виде. В отличие от дигоксина дигитоксин метаболизируется в печени, оптимальная доза — 0,07-0,1 мг/сут.
Побочные эффекты и гликозидная интоксикация. Сердечные гликозиды могут вызвать брадикардию. При применении сердечных гликозидов возможно развитие гликозидной интоксикации. Способствовать интоксикации гликозидами могут инфаркт миокарда, гипоксемия, гипокалиемия, гипомагниемия, гиперкальциемия, почечная недостаточность, гипотиреоз, электрическая кардиоверсия, пожилой возраст. Следует помнить, что совместное назначение сердечных гликозидов с хинидином, верапамилом, амиодароном, пропафеноном может приводить к увеличению концентрации гликозидов в крови и уменьшать их почечную и внепочечную элиминацию, поэтому для предупреждения интоксикации дозу дигоксина в таких случаях необходимо уменьшить в 2 раза.
- Диспептические расстройства — тошнота, рвота, снижение аппетита.
- Нарушения ритма сердца в виде желудочковой экстрасистолии, непароксизмальной АВ-узловой тахикардии, желудочковой тахикардии (в том числе многофокусной). Фибрилляция желудочков возникает редко.
- Нарушения АВ-проводимости различной степени, СА-блокада.
- Наиболее характерным нарушением ритма и проводимости при гликозидной интоксикации считают непароксизмальную наджелудочковую тахикардию с АВ-блокадой, поэтому при лечении сердечными гликозидами и сохранении тахикардии у больного необходимо исключить их передозировку.
Хроническая гликозидная интоксикация может проявляться также сщжением массы тела, невропатиями, гинекомастией, делирием. Характерно нарушение зрения в виде появления жёлтых кругов при взгляде на источник света.
Лечение хронической сердечной недостаточности адреноблокаторами
Вопрос о назначении /3-адреноблокаторов при хронической систолической сердечной недостаточности дискутируется. При незначительной и умеренной степени выраженности хронической сердечной недостаточности возможно применение /3-адреноблокаторов (при фракции выброса левого желудочка более 30% и отсутствии противопоказаний к их назначению со стороны других органов.
Механизм благоприятного действия /3-адреноблокаторов при хронической сердечной недостаточности обусловлен следующими факторами:
- Прямая защита миокарда от неблагоприятного воздействия катехоламинов.
- Защита от индуцированной катехоламинами гипокалиемии.
- Улучшение кровотока в венечных артериях вследствие уменьшения ЧСС и улучшения диастолического расслабления миокарда.
- Уменьшение воздействия сосудосуживающих систем (например, вследствие уменьшения секреции ренина).
- Потенцирование вазодилатирующей калликреин-кининовой системы.
- Увеличение вклада левого предсердия в наполнение левого желудочка за счёт улучшения расслабления последнего.
В настоящее время из /3-адреноблокаторов для лечения хронической сердечной недостаточности рекомендован к применению карведилол — f5- и ai-адре-ноблокатор с вазодилатирующими свойствами. Начальная доза карведилола составляет 3,125 мг 2 раза в сутки с последующим увеличением дозы до 6,25, 12,5 или 25 мг 2 раза в сутки при отсутствии побочного действия в виде артериальной гипотензии, брадикардии, снижения фракции выброса левого желудочка (по данным эхокардиографии) и других отрицательных проявлений действия /3-адреноблокаторов. Кроме того, рекомендованы метопролол, начиная с дозы 12,5 мг 2 раза в день, бисопролол по 1,25 мг 1 раз в день под контролем фракций выброса желудочков.
Спиронолактон при хронической сердечной недостаточности
Установлено, что назначение антагониста альдостерона спиронолактона в дозе 25 мг 1-2 раза в день (при отсутствии противопоказаний) способствует увеличению продолжительности жизни больных с сердечной недостаточностью. Этот препарат повсеместно рекомендуют к применению, несмотря на отсутствие видимого влияния на качество жизни больных.
Периферические вазодилататоры при сердечной недостаточности
Периферические вазодилататоры назначают больным с хронической сердечной недостаточностью при наличии противопоказаний или плохой переносимости ингибиторов АПФ. Из периферических вазодшгатяторов применяют гидрала-зин в дозе до 300 мг/сут, изосорбид динитрат в дозе до 160 мг/сут.
Другие кардиотонические средства для лечения хронической недостаточности
/З-Адреномиметики (добутамин), ингибиторы фосфодиэстеразы (амринон) назначают обычно на 1-2 нед в конечной стадии сердечной недостаточности либо при резком ухудшении состояния больных.
Лечение сердечной недостаточности с помощью антикоагулянтов
Больные с хронической сердечной недостаточностью подвержены высокому риску тромбоэмболических осложнений. Возможна как ТЭЛА вследствие венозного тромбоза, так и тромбоэмболия сосудов большого круга кровообращения, обусловленная внутрисердечными тромбами или фибрилляцией предсердий. Назначение непрямых антикоагулянтов больным с хронической сердечной недостаточностью рекомендовано при наличии фибрилляции предсердий и тромбозах в анамнезе.
Антиаритмические препараты при сердечной недостаточности
При наличии показаний к назначению антиаритмических средств (фибрилляция предсердий, желудочковые тахикардии) рекомендуют использовать амио-дарон в дозе 100-200 мг/сут. Этот препарат даёт минимальный отрицательный инотропный эффект, в то время как большинство остальных препаратов этого класса снижают фракцию выброса левого желудочка. Кроме того, сами антиаритмические средства могут провоцировать аритмии (проаритмический эффект). Следует помнить, что при совместном назначении с сердечными гликозидами дозу последних необходимо уменьшить вдвое.
Не рекомендованы к применению при лечении хронической сердечной недостаточности
При лечении хронической сердечной недостаточности следует помнить о лекарственных взаимодействиях и возможном отрицательном влиянии некоторых средств на течение заболевания. Необходимо избегать следующих препаратов:
- НПВС — вызывают ингибирование синтеза в том числе вазодилатирую-щих Пг и задержку ионов натрия и воды.
- Антиаритмические средства I класса — дают проаритмический эффект.
- Блокаторы медленных кальциевых каналов (верапамил, дилтиазем, дигид-ропиридины первого поколения) снижают сократимость миокарда.
- Трициклические антидепрессанты стимулируют эктопическую активность сердца.
- Глюкокортикоиды (ингибируют образование вазодилатирующих Пг и задерживают ионы натрия и воду).
Хроническая сердечная недостаточность — лечение хирургическими методами
При развитии хронической сердечной недостаточности на фоне ИБС необходимо рассмотреть вопрос о своевременной реваскуляризации миокарда. При наличии сердечной недостаточности на фоне брадиаритмии показана ЭКС. Частые пароксизмы желудочковой тахикардии считают показанием для имплантации кардиовертера-дефибриллятора. Крайняя мера в лечении рефрактерной сердечной недостаточности — пересадка сердца. Пятилетняя выживаемость при своевременно проведённой пересадке сердца составляет 70%.
Прогноз хронической сердечной недостаточности
В целом трёхлетняя выживаемость больных с хронической систолической сердечной недостаточностью составляет 50%. Смертность от хронической систолической сердечной недостаточности составляет 19% в год. Ниже приведены факторы, наличие которых коррелирует с плохим прогнозом у больных с сердечной недостаточностью.
- Снижение фракции выброса левого желудочка менее 25%.
- Невозможность подъёма на один этаж и движения в нормальном темпе более 3 мин.
- Снижение содержания ионов-патрия плазмы крови менее 133 мэкв/л.
- Снижение концентрации ионов калия плазмы крови менее 3 мэкв/л.
- Увеличение содержания в крови норадреналина.
- Частая желудочковая экстрасистолия при суточном мониторировании ЭКГ.
Риск внезапной сердечной смерти больных с сердечной недостаточностью в 5 раз выше, чем в общей популяции. Большинство больных с хронической сердечной недостаточностью погибают внезапно, преимущественно от возникновения фибрилляции желудочков. Профилактическое назначение антиаритмических средств не предупреждает данного осложнения.
Хроническая сердечная недостаточность у больных пожилого возраста
CHRONIC HEART FAILURE IN ELDERLY PATIENTS
L.B. Lazebnik, S.L. Postnikova
Хроническая сердечная недостаточность (ХСН) является одной из основных проблем современной геронтологии и гериатрии. В статье приводятся рекомендации по медикаментозному и хирургическому лечению пожилых и старых больных, страдающих ХСН. Подчеркивается важность обучения больного методам самоконтроля и ведению дневника, образец которого приводится.
Chronic heart failure (CHF) is one of the main problem of modern gerontology and geriatrics. The paper gives recommendations on medical and surgical treatment of elderly and old patients with CHF. It shows it is important to educate the patient to control himself and to keep a diary whose model is presented.
Л.Б. Лазебник, д.м.н. проф. С.Л. Постникова — РМАПО, кафедра геронтологии и гериатрии
L.B. Lazebnik, prof. Dr. Sci. S.L. Postnikova — Department of Gerontology and Geriatrics, Russian Medical Academy of Postgraduate Training
С ердечная недостаточность (СН) — синдром, при котором дисфункция миокарда приводит к неспособности сердечной мышцы поддерживать метаболизм организма на адекватном уровне. СН развивается, как правило, в результате действия нескольких факторов и чаще имеет хронический характер.
В настоящее время хроническая сердечная недостаточность (ХСН) является одной из главных проблем здравоохранения во многих странах мира, в том числе в России, США и экономически развитых странах Запада, так как очень велики ежегодные расходы на лечение больных, а смертность остается высокой. Точных данных о заболеваемости и распространенности ХСН в большинстве стран нет. По данным Фремингемского исследования, заболеваемость ХСН увеличивается с возрастом, т. е. ХСН чаще наблюдается у людей пожилого и старческого возраста. ХСН ежегодно развивается у 1% лиц старше 60 лет и примерно у 10% лиц старше 75 лет. Очевидно, что отчетливая тенденция к «постарению» населения планеты в последние десятилетия вызовет еще большую распространенность ХСН, которой страдает в настоящее время 1 — 2% населения в экономически развитых странах мира. Поэтому ХСН является одной из основных проблем в современной геронтологии и гериатрии и имеет глобальный социально-экономический характер.
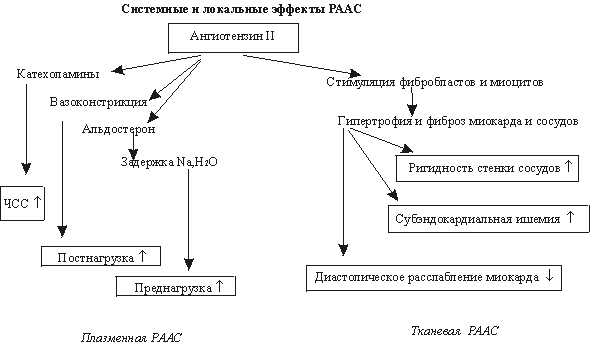
ХСН чаще развивается в результате заболеваний сердечно-сосудистой системы, но может иметь первично и «внесердечную» этиологию. В большинстве экономически развитых стран мира наиболее частой причиной ХСН является ишемическая болезнь сердца (ИБС) в сочетании с артериальной гипертонией или без нее. На втором месте среди причин развития ХСН стоит артериальная гипертония и на третьем — приобретенные пороки сердца, чаще ревматического генеза. Другими причинами ХСН могут быть дилатационная кардиомиопатия, миокардиты, поражение миокарда вследствие хронической алкогольной, кокаиновой и иной интоксикации, констриктивный перикардит, гипертоническая и рестриктивная кардиомиопатии, инфекционный эндокардит, опухоли сердца, врожденные пороки сердца. Среди внесердечных причин, приводящих к появлению ХСН, необходимо отметить болезни органов дыхания с сопутствующей легочной гипертензией, тромбоэмболию легочной артерии, гипо- и гипертиреоз, диффузные болезни соединительной ткани, анемии, гемохроматоз, амилоидоз, саркоидоз, бери-бери, дефицит селена, карнитина, кардиотоксическое действие лекарственных препаратов, лучевую терапию с вовлечением средостения, интоксикацию солями тяжелых металлов.
У больных пожилого и старческого возраста нередко имеется несколько этиологических факторов, приводящих к развитию ХСН. Например, наличие в анамнезе инфаркта миокарда и сопутствующего хронического обструктивного бронхита и/или артериальной гипертонии. Именно больным старших возрастных групп свойственна полиморбидность, и СН у этого контингента носит многофакторный характер. Также необходимо учитывать и возрастные изменения миокарда (гипертрофия, фиброз, формирующие «старческое сердце»), которые снижают его сократительную способность, а отложение амилоида в тканях сердца лишь усугубляет этот процесс.
Ведущим звеном патогенеза СН в настоящее время считается активация важнейших нейрогуморальных систем организма — ренин-ангиотензин-альдостероновой (РААС) и симпатико-адреналовой (САС) — на фоне снижения сердечного выброса. В результате происходит образование биологически активного вещества — ангиотензина II, который является мощным вазоконстриктором, стимулирует выброс альдостерона, повышает активность САС (стимулирует выброс норадреналина). Норадреналин, в свою очередь, может активировать РААС (стимулирует синтез ренина). Также следует учитывать, что активируются и локальные гормональные системы (прежде всего РААС), которые существуют в различных органах и тканях организма. Активация тканевых РААС происходит параллельно плазменной (циркулирующей), но действие этих систем различается. Плазменная РААС активируется быстро, но ее эффект сохраняется недолго (см. рисунок). Активность тканевых РААС сохраняется длительное время. Синтезирующийся в миокарде ангиотензин II стимулирует гипертрофию и фиброз мышечных волокон. Кроме того, он активирует локальный синтез норадреналина. Аналогичные изменения наблюдаются в гладкой мускулатуре периферических сосудов и приводят к ее гипертрофии.
Таблица 1. Основные препараты ИАКФ и их дозы, используемые при лечении СН
Особенности современного лечения хронической сердечной недостаточности
Зав. кафедрой внутренних болезней № 1 ММА им. И.М. Сеченова, чл.-корр. РАМН
Хроническая сердечная недостаточность (ХСН) — это синдром, развивающийся в
результате различных заболеваний сердечно-сосудистой системы, приводящий к
снижению насосной функции сердца, хронической гиперактивации нейрогормональных
систем. Проявляется одышкой, сердцебиением, повышенной утомляемостью,
Основные причины ХСН
Главными причинами, составляющими более половины всех случаев ХСН, являются
ишемическая болезнь сердца (ИБС) и гипертоническая болезнь (ГБ) или их
сочетание. При ИБС развитие острого инфаркта миокарда с последующим очаговым
снижением сократимости миокарда и дилятацией полости ЛЖ (именуемое
ремоделированием) является наиболее частой причиной ХСН. При длительно
существующей хронической коронарной недостаточности без инфаркта может
Клиническая картина ХСН складывается из субъективных и органных изменений. В
начальном периоде ХСН проявляется только при физической нагрузке, когда
появляются одышка, сердцебиение, чрезмерная утомляемость. В покое эти явления
Источник: heal-cardio.ru
Хроническая сердечная недостаточность

Симптомы хронической сердечной недостаточности
Существует несколько основных классических проявлений ХСН, которые возникают вне зависимости от степени поражения других органов организма. Выраженность этих симптомов полностью зависит от формы сердечной недостаточности и ее тяжести.
Основные жалобы пациентов, страдающих ХСН:
Тахикардия (учащение сердцебиения более 80 — 90 ударов в минуту).
Одышка, сопровождающаяся учащением неглубокого дыхания.
Повышенная утомляемость и заметное снижение переносимости физических нагрузок.Возникновение сухого кашля, который потом переходит в кашель с отхождением мокроты. Иногда в ней определяются прожилки алой крови.Отеки туловища. Сначала они появляются на стопах, затем поднимаются на голени и бедра. После этого отекает поясница и область живота. Может скапливаться жидкость в легких.Появление ортопноэ – усиление одышки при горизонтальном положении туловища. В данном случае в лежачем состоянии у пациента также усиливается кашель.
Классификация ХСН и ее проявления
Существует несколько классификаций хронической сердечной недостаточности в зависимости от стадии заболевания, переносимости физической нагрузки и нарушения функции отделов сердца.
1 стадия. Происходят начальные изменения и снижается функция левого желудочка. В связи с тем, что нарушения кровообращения еще не происходит, клинически проявлений никаких нет.
2А стадия. В этом случае происходит нарушение движения крови в одном из двух кругов кровообращения. В итоге происходит застой жидкости либо в легких, либо в нижних отделах туловища, преимущественно на ногах.
2Б стадия. Происходит нарушения гемодинамики в обоих кругах кровообращения и появляются выраженные изменения в сосудах и сердце. В большей степени проявляются отеки на ногах вместе с хрипами в легких.
3 стадия. Появляются ярко выраженные отеки не только на ногах, но и на пояснице, бедрах. Возникает асцит (скопление жидкости в брюшной полости) и анасарка (отечность всего тела). В данной стадии происходят необратимые изменения таких органов как почки, головной мозг, сердце и легкие.
Деление ХСН на функциональные классы (ФК) в зависимости от переносимости физической нагрузки:
I ФК – повседневная физическая нагрузка переносится бессимптомно и легко. Усиленная физическая активность может приводить к одышке. Восстановление сил после нее немного замедляется. Данные проявления сердечной недостаточности могут вообще отсутствовать.
II ФК – пациенты немного ограничены в активности. В состоянии покоя никаких симптомов нет. При обычной повседневной физической нагрузке появляется учащенное сердцебиение, затрудненное дыхание и усталость.
III ФК – физическая активность заметно ограничена. В покое состояние удовлетворительное. При физической активности меньше привычной степени возникают вышеописанные симптомы.
IV ФК – абсолютно любая физическая активность доставляет дискомфорт. Симптомы сердечной недостаточности беспокоят в состоянии покоя и значительно усиливаются даже при малейших движениях.
Причины развития
К сердечной недостаточности может привести абсолютно любая патология, поражающая миокард и структуры сердечно-сосудистой системы.
Заболевания, непосредственно поражающие миокард:
хроническая ишемическая болезнь сердца (при поражении сосудов сердца вследствие атеросклероза);
ишемическая болезнь сердца после перенесенного инфаркта миокарда (при гибели определенного участка сердечной мышцы).
Патология эндокринной системы:
сахарный диабет (нарушение углеводного обмена в организме, которое ведет к постоянному повышению уровня глюкозы в крови);
заболевания надпочечников с нарушением секреции гормонов;
снижение или повышение функции щитовидной железы (гипотиреоз, гипертиреоз).
Нарушение питания и его последствия:
истощение организма;
избыток массы тела за счет жировой ткани;
недостаток поступления с пищей микроэлементов и витаминов.
Некоторые заболевания, сопровождающиеся отложением в тканях несвойственных им структур:
саркоидоз (наличие плотных узлов, сдавливающих нормальные ткани, нарушая их структуру);
амилоидоз (отложение в тканях особого белково-углеводного комплекса (амилоида), который нарушает работу органа).
Иные заболевания:
хроническая почечная недостаточность в терминальной стадии (при необратимых изменениях органа);
ВИЧ-инфекция.
Функциональные нарушения работы сердца:
нарушения сердечного ритма;
блокады (нарушения проведения нервного импульса по структурам сердца);
приобретенные и врожденные сердечные пороки.
Воспалительные заболевания сердца (миокардиты, эндокардиты и перикардиты).
Хронически повышенное артериальное давление (артериальная гипертензия).Существует ряд предрасполагающих факторов и заболеваний, которые значительно повышают риск развития хронической сердечной недостаточности. Некоторые из них могут самостоятельно вызывать патологию. К таковым относятся:
курение;
ожирение;
алкоголизм;
аритмии;
заболевания почек;
повышенное давление;
нарушение обмена жиров в организме (повышение уровня холестерина и др.);
сахарный диабет.
Диагностика сердечной недостаточности
Для того, чтобы определить сердечную недостаточность, необходимо выполнить ряд исследований и изучить состояние пациента в состоянии покоя и в динамике.
При изучении анамнеза важно определить время, когда начала беспокоить одышка, отеки и утомляемость. Необходимо обратить внимание на такой симптом, как кашель, его характер и давность. Нужно узнать, имеются ли у больного пороки сердца или иная патология сердечно-сосудистой системы. Принимались ли ранее токсичные лекарственные препараты, было ли нарушение иммунных систем организма и наличие опасных инфекционных заболеваний с осложнениями.
Осматривая пациента можно определить бледность кожных покровов и отечность ног. При прослушивании сердца бывают шумы и признаки застоя жидкости в легких.Общий анализ крови и мочи могут указать на какую-либо сопутствующую патологию или развивающиеся осложнения, в частности, воспалительного характера.
При изучении биохимического анализа крови определяется уровень холестерина. Это необходимо для оценки степени риска развития осложнений и назначения правильного комплекса поддерживающего лечения. Изучается количественное содержания креатинина, мочевины и мочевой кислоты. Это свидетельствует о распаде мышечной ткани, белка и веществ клеточного ядра. Определяется уровень калия, который может «подсказать» о вероятном сопутствующем поражении органов.Иммунологическое исследование крови может показать уровень C-реактивного белка, увеличивающегося при воспалительных процессах. Также определяется наличие антител к микроорганизмам, поражающим сердечные ткани.
Развернутые показатели коагулограммы позволят изучить возможные осложнения или наличие сердечной недостаточности. При помощи анализа определяется повышенная свертываемость или появление в крови веществ, свидетельствующих о распаде тромбов. Последних показателей в норме определяться не должно.Определение натрий-уретического гормона может показать наличие, степень и эффективность терапии хронической сердечной недостаточности.
Диагностировать сердечную недостаточность и определить ее функциональный класс можно следующим способом. На протяжении 10 минут пациент отдыхает, а затем в обычном темпе начинает движение. Ходьба длиться 6 минут. При появлении сильной одышки, выраженной тахикардии или слабости тест прекращается и замеряется пройденное расстояние. Интерпретация результатов исследования:
550 метров и более – сердечная недостаточность отсутствует;
от 425 до 550 метров – ФК I;
от 300 до 425 метров – ФК II;
от 150 до 300 метров – ФК III;
150 метров и менее – ФК IV.
Электрокардиография (ЭКГ) может определить изменения сердечного ритма или перегрузку некоторых его отделов, что свидетельствует о ХСН. Иногда видны рубцовые изменения после перенесенного инфаркта миокарда и увеличение (гипертрофия) определенной сердечной камеры.Рентгенограмма грудной клетки определяет наличие жидкости в плевральной полости, что свидетельствует об имеющемся застое в малом круге кровообращения. Также можно оценить размеры сердца, в частности, его увеличение.
Ультразвуковое исследование (УЗИ, эхокардиография) позволяет оценить много факторов. Таким образом, можно узнать различные данные о величине сердечных камер и толщине их стенок, состояние клапанного аппарата и эффективность сердечных сокращений. Данное исследование также определяет движение крови по сосудам.
При наличии постоянной формы мерцательной аритмии (фибрилляции предсердий) выполняется чреспищеводное УЗИ. Оно необходимо для определения наличия возможных тромбов в правом предсердии и их размеров. Для изучения резервных способностей сердечной мышцы иногда производят стресс-эхокардиографию. Суть метода заключается в ультразвуковом исследовании до физической нагрузки и после нее. Это исследование также определяет жизнеспособные участки миокарда.Компьютерная спиральная томография. В данном исследовании используется выстраивание рентгеновских снимков разной глубины в сочетании с МРТ (магнитно-резонансной томографией). В итоге получается максимально точное изображение сердца.При помощи коронарографии определяется степень проходимости сосудов сердца. Для этого в кровеносное русло вводится контрастное вещество, заметное при рентгеновском излучении. При помощи снимков затем изучается поступление этого вещества в собственные сосуды сердца.В случае, когда невозможно достоверно определить причину заболевания, прибегают к эндомиокардиальной биопсии. Суть исследования заключается во взятии внутренней оболочки сердца для ее изучения.
Лечение хронической сердечной недостаточности
Терапия сердечной недостаточности, как и многих других заболеваний, начинается с правильного образа жизни и здорового питания. В основе диеты лежит ограничение потребления поваренной соли приблизительно до 2,5 – 3 грамм в сутки. Объем выпиваемой жидкости должен составлять около 1 – 1,3 литра.Пища должна быть легко усваиваемой и высококалорийной с достаточным количеством витаминов. При этом важно регулярно взвешиваться, т.к. увеличение веса даже на пару килограмм в день может свидетельствовать о задержке в организме жидкости. Следовательно, данное состояние усугубляет течение ХСН.Пациентам с сердечной недостаточностью крайне важна правильная постоянная физическая нагрузка в зависимости от функционального класса заболевания. Снижение двигательной активности необходимо при наличии какого-либо воспалительного процесса в сердечной мышце.
Основные группы медицинских препаратов, применяемых при хронической сердечной недостаточности:
И-АПФ (ингибиторы ангиотензин-превращающего фермента). Данные препараты замедляют развитие и прогрессирование ХСН. Имеют защитную функцию для почек, сердца и сосудов, снижают повышенное артериальное давление.Препараты группы антагонистов рецепторов к ангиотензину. Эти лекарственные вещества в отличие от ингибиторов АПФ в большей степени блокируют фермент. Назначают такие препараты при аллергии на и-АПФ или при появлении побочных эффектов в виде сухого кашля. Иногда оба этих лекарства комбинируют между собой.Бета-адреноблокаторы – препараты, снижающие давление и частоту сокращений сердца. Эти вещества имеют дополнительное антиаритмическое свойство. Назначаются совместно с ингибиторами АПФ.
Препараты антагонистов рецепторов к альдостерону – вещества, обладающие слабым мочегонным действием. Они задерживают в организме калий и применяются пациентами после инфаркта миокарда или при сильно выраженной ХСН.Мочегонные вещества (диуретики). Используются для выведения из организма избытка жидкости и солей.Сердечные гликозиды – лекарственные вещества, повышающие силу сердечного выброса. Данные препараты растительного происхождения используются в основном при сочетании сердечной недостаточности и мерцательной аритмии.Дополнительно используемые препараты при лечении сердечной недостаточности:
Статины. Данные лекарственные вещества применяются для снижения уровня жиров в крови. Это необходимо для минимизации их отложения в сосудистой стенке организма. Предпочтение таким препаратам отдается при хронической сердечной недостаточности, вызванной ишемической болезнью сердца.Антикоагулянты непрямого действия. Такие препараты препятствуют синтезу в печени специальных веществ, способствующих повышенному тромбообразованию.
Вспомогательные препараты, применяемые при осложненном варианте сердечной недостаточности:
Нитраты – вещества, в основе химической формулы которых лежат соли азотной кислоты. Такие препараты расширяют сосуды и способствуют улучшению кровообращения. Применяются в основном при стенокардии и ишемии сердца.Антагонисты кальция. Используются при стенокардии, стойком повышении артериального давления, легочной гипертензии или клапанной недостаточности.Противоаритмические препараты.Дезагреганты. Наряду с антикоагулянтами снижают свертываемость крови. Используются в качестве профилактики тромбозов: инфарктов и ишемических инсультов.Инотропные негликозидные стимуляторы. Повышают силу сокращения сердца и артериальное давление.
Электрофизиологические способы лечения ХСН
Установка постоянного кардиостимулятора (ИВР – искусственного водителя ритма), который задает сердцу правильный ритм.Имплантация дефибриллятора-кардиовертера. Такое устройство помимо создания постоянного ритма способно выдавать электрический разряд при возникновении жизнеугрожающих аритмий.
Хирургические способы лечения
Аортокоронарное и маммарокоронарное шунтирование. Суть процедуры состоит в создании дополнительных сосудов от аорты или внутренней грудной артерии к сердечной мышце. Данное хирургическое вмешательство выполняется при выраженном поражении собственных артерий сердца.При значительном стенозе или недостаточности клапанов выполняют хирургическую их коррекцию.При невозможности или неэффективности использования вышеописанных способов терапии показана полная пересадка сердца.
Применение специальных искусственных аппаратов вспомогательного кровообращения. Они представляют собой что-то наподобие желудочков сердца, которые имплантируются внутрь организма и соединяются со специальными батареями, расположенными на поясе пациента.При значительном увеличении полости камер сердца, в частности, при дилатационной кардиомиопатии, сердце «укутывают» эластическим каркасом, который в сочетании с правильной медикаментозной терапией замедляет прогрессирование ХСН.
Осложнения сердечной недостаточности
Основные последствия, которые возникают при сердечной, патологии могут затрагивать как работу самого сердца, так и других внутренних органов. Основные осложнения:
Печеночная недостаточность из-за застоя крови.
Увеличение сердца.
Нарушение проводимости сердца и его ритма.
Возникновение тромбозов в любом органе или ткани организма.
Истощение сердечной деятельности.
Внезапная коронарная (сердечная) смерть.
Профилактика ХСН
Профилактику хронической сердечной недостаточности принято делить на первичную и вторичную.
В основе первичной профилактики лежат мероприятия, которые препятствуют возникновению ХСН у лиц с высокой предрасположенностью к заболеванию. К ней относится нормализация питания и физических нагрузок, снижение факторов риска (предупреждение ожирения и отказ от курения).Вторичная профилактика заключается в своевременном лечении хронических сердечных заболеваний. Она выполняется для предупреждения усугубления патологии. К основным мероприятиям относится терапия артериальной гипертензии, ишемической болезни сердца, аритмий, нарушений липидного обмена, хирургическое лечение сердечных пороков.Согласно мировой статистике выживаемость пациентов полностью зависит от тяжести заболевания и функционального класса. В среднем порядка 50 – 60 % больных нормально существуют на протяжении 3 – 4 лет. Данное заболевание в настоящие дни имеет тенденцию к большему распространению.
Источник: www.medroid.ru
Лечение хронической сердечной недостаточности
Хроническая сердечная недостаточность — это синдром, который характеризуется развитием определенных симптомов (одышки, тахикардии, отеков, хронической усталости) и характерных объективных признаков (набуханием яремных вен, влажных хрипов, преимущественно над нижними долями легких). Данная клиническая картина возникает в результате необратимых нарушений структуры и/или функциональных возможностей сердца, вследствие чего происходит снижение сердечного выброса или повышение давления наполнения сердца.
Среди методов лечения СН главная роль остается за консервативной терапией. Основные цели лечения СН — уменьшение симптомов болезни, улучшение качества жизни пациента и повышение ее продолжительности.
Группы препаратов, применяемые для лечения недостаточности сердечной деятельности:
- с доказанной высокой эффективностью, положительно влияющие на прогноз заболевания;
- эффективные в плане купирования симптомов СН, но не оказывающие влияния на продолжительность жизни пациента;
- с менее определенной эффективностью;
- с недоказанной эффективностью;
- препараты, способные усугубить течение СН.

К препаратам, рекомендованным для назначения всем больным с СН, относятся:
- ингибиторы ангиотензинпревращающего фермента (иАПФ);
- блокаторы рецепторов к ангиотензину II (БРА ) при непереносимости иАПФ;
- бета-адреноблокаторы (β-блокаторы);
- антагонисты минералкортикоидных рецепторов (АМР).


ИАПФ обладают доказанным кардиопротективным действием и снижают возможность наступления смерти от СН, развития инфаркта миокарда. Блокируют ренин-ангиотензиновую систему, снижают уровень альдостерона. Эти механизмы приводят к замедлению процессов гипертрофии и дистрофии миокарда, в ряде случаев к их обратному развитию. При применении иАПФ снижается АД за счет уменьшения сопротивления сосудов, снижается нагрузка на сердечную мышцу, повышается ударный и минутный объем сердца, возрастает переносимость физических нагрузок сердечной мышцей.
В отличие от терапии артериальной гипертензии, где подбирается минимальная дозировка для поддержания целевых цифр АД, при лечении СН эти лекарственные средства назначаются в максимальных дозах, переносимых пациентом. Так как препараты назначаются и гипертоникам, и людям с изначальной нормотонией, доза титруется постепенно. Плавное повышение необходимо во избежание выраженной гипотензии. Обширной доказательной базой обладают следующие препараты:
- Каптоприл;
- Эналаприл;
- Лизиноприл;
- Рамиприл ;
- Трандолаприл.
В настоящий момент наибольшей популярностью как в амбулаторной практике, так и для стационарного лечения больных с ХСН пользуются Лизиноприл и Рамиприл. Препарат Каптоприл обладает слишком короткой продолжительностью действия, поэтому применяется только как препарат неотложной помощи для купирования неосложненных гипертонических кризов.

Противопоказания к назначению:
- индивидуальная гиперчувствительность к составляющим препарата;
- отек Квинке (после приема препарата и в анамнезе);
- гестационный период, лактация;
- возраст младше 18 лет;
- гиперкалиемия;
- двустороннее сужение артерий, кровоснабжающих почки (или сужение артерии, кровоснабжающей единственную почку).
ИАПФ достаточно часто вызывают неприятный побочный эффект — постоянный сухой кашель. Это явление связано с нарушением метаболизма брадикинина. Высокая его концентрация раздражает кашлевые рецепторы бронхиального дерева. При плохой переносимости иАПФ должны быть заменены на БРА, обладающие сходными положительными эффектами, но не влияющие на обмен кининов. Однако БРА не должны рассматриваться как средства первой линии. В начале лечения предпочтение всегда отдается иАПФ как наиболее изученным средствам.
Среди БРА доказательная база есть у следующих веществ:
Наибольшей степенью доказанности эффективности среди БРА обладает Кандесартан.
Противопоказания к приему БРА:
- гиперчувствительность к любому из компонентов препарата;
- цирроз печени класса С по шкале Чайлд-Пью ;
- билиарный цирроз ;
- беременность, грудное вскармливание;
- застой желчи;
- возраст менее 18 лет;
- совместное применение с препаратом Алискирен у лиц, страдающих сахарным диабетом 2-го типа или нарушением функции почек (ХБП С3 и выше).

Бета-адреноблокаторы обладают антиангинальным, антигипертензивным, антиаритмическим свойством. Препараты снижают частоту и интенсивность сокращений сердца, уменьшая тем самым количество кислорода, потребляемого сердечной мышцей. Уменьшают частоту повторных инфарктов миокарда, вероятность внезапной смерти. Улучшают адаптированность к физическим нагрузкам и качество жизни в целом. Как и иАПФ, назначаются в максимально переносимой дозе, с постепенной титрацией от минимальной.

Высокоселективные бета-блокаторы с доказанной эффективность, по данным клинических исследований:
- Бисопролол;
- Карведилол;
- Небиволол;
- Метопролола сукцинат.
В клинической практике ХСН часто сочетается с артериальной гипертензией, симптомным атеросклерозом коронарных артерий, постоянной формой фибрилляции предсердий. Наиболее эффективными бета-блокаторами для снижения артериального давления, предотвращения приступов стенокардии, контроля частоты сокращений сердца и уменьшения симптомов сердечной недостаточности являются Бисопролол и Метопролола сукцинат.
- АВ-блокада II и III степени ;
- совместное применение с Добутамином, Норадреналином, Допамином;
- недостаточность сердечной деятельности в стадии декомпенсации;
- значительная синусовая брадикардия;
- синдром слабости синусового узла — СССУ ;
- кардиогенный шок;
- тяжелые нарушения кровообращения в сосудах нижних конечностей;
- артериальная гипотония;
- индивидуальная гиперчувствительность к составляющим лекарственного средства ;
- одновременный прием с блокаторами медленных кальциевых каналов (подобных Верапамилу);
- возраст менее 18 лет.
К препаратам с доказанной эффективностью относятся Спиронолактон и Эплеренон. Препараты блокируют рецепторы альдостерона. Обладают антидиуретическим действием, обеспечивают кардиопротекцию.
Назначаются пациентам 2-4-го функциональных классов сердечной недостаточности, которые не достигли контроля над заболеванием комбинацией иАПФ и бета-блокаторов.

- гиперкалиемия;
- ХБП С4-5 (клиренс креатинина после инфаркта миокарда и с хронической сердечной недостаточностью );
- уровень плазменного креатинина >177 ммоль/л у мужчин или >159 ммоль/л у женщин;
- цирроз печени класса С по шкале Чайлда-Пью;
- совместный прием с калийсберегающими диуретиками, препаратами калия и др.средствами, повышающими уровень калия в крови;
- детский возраст менее 18 лет;
- повышенная чувствительность к составляющим лекарственного средства.
К препаратам, уменьшающим симптомы СН, относятся диуретики, блокаторы медленных натриевых каналов (If), комбинация гидролазина с изосорбида динитратом.
Мочегонные препараты показаны при наличии застойных явлений, возникающих на фоне приема иАПФ (или БРА), бета-блокаторов, антагонистов минералкортикоидных рецепторов в оптимальных дозировках.
Среди петлевых диуретиков наибольшей активностью обладают Фуросемид и Торасемид. В настоящий момент Фуросемид отходит на второй план, в основном он применяется как препарат экстренной помощи. Торасемид является препаратом длительного действия, обладает благоприятным профилем безопасности, реже вызывает гипокалиемию, чем Фуросемид. Дополнительным эффектом является блокада рецепторов к альдестерону в сердечной мышце, что существенно замедляет процессы ремоделирования в сердце.

- почечная недостаточность с развитием анурией;
- значительная печеночная недостаточность — кома и прекома;
- гипокалиемия и/или гипонатриемия, не поддающиеся коррекции;
- значительная дегидратация;
- существенные нарушения оттока мочи любой этиологии (даже при одностороннем блоке мочевыводящих путей);
- интоксикация сердечными гликозидами;
- острый гломерулонефрит;
- декомпенсированные пороки сердца — сужение отверстий аортального и митрального клапанов, гипертрофическая кардиомиопатия с обструкцией выносящего тракта левого желудочка сердца ;
- повышенное значение центрального венозного давления (свыше 10 мм рт.ст.);
- повышенное значение показателя мочевой кислоты;
- совместный прием с аминогликозидами и цефалоспоринами (требуется отмена препарата на период лечения антибиотиками);
- беременность и грудное вскармливание;
- возраст младше 18 лет;
- индивидуальная непереносимость любого компонента препарата.
Среди тиазидных диуретиков наиболее часто применяют Гидрохлортиазид, Индапамид и тиазидоподобный диуретик Хлорталидон. Наиболее современным препаратом с доказанной результативностью является Хлорталидон.
- анурия;
- тяжелая почечная (ХБП С4-5) и печеночная недостаточность (цирроз класса С по Чайлд-Пью);
- электролитные расстройства (гипокалиемия, гиперкальциемия, гипонатриемия) и нарушения кислотно-основного состояния (гипохлоремический алкалоз);
- повышения уровня мочевой кислоты;
- беременность и период грудного вскармливания ;
- повышенная чувствительность к составляющим диуретика или сульфаниламидам.
Существуют также калийсберегающие диуретики (Триамтерен, Амилорид ). Их не следует сочетать с антагонистами минералкортикоидных рецепторов, т. к. они также вызывают задержку калия в организме. Гиперкалиемия способна вызывать тяжелые брадиаритмии, вплоть до асистолии.
В настоящий момент в клинической практике используется единственный представитель этого класса — Ивабрадин. Назначение Ивабрадина показано при невозможности применения бета-адреноблокаторов (наличие серьезных противопоказаний), а также в комбинации с ними у пациентов с низкой фракцией выброса и частотой сердечных сокращений более 70 ударов за одну минуту. Снижение числа сердечных сокращений до целевых значений (в идеале не более 60 ударов в одну минуту) приводит к уменьшению нагрузки на сердечную мышцу, замедляя тем самым процессы гипертрофии миокарда.

- непереносимость любого из компонентов препарата;
- частота сердечных сокращений в покое менее 60 ударов за одну минуту (до начала лечения);
- кардиогенный шок любой этиологии;
- острый инфаркт миокарда ;
- выраженная артериальная гипотония (систолическое артериальное давление ниже 90 мм рт.ст. и диастолическое — ниже 50 мм рт.ст.);
- клинически выраженная печеночная недостаточность — цирроз печени класса С по шкале Чайлд-Пью;
- синдром слабости синусового узла;
- острая сердечная недостаточность, декомпенсация хронической сердечной недостаточности ;
- наличие искусственного водителя ритма (электрокардиостимулятора), работающего в режиме постоянной стимуляции;
- нестабильная стенокардия;
- полная атриовентрикулярная блокада;
- совместное применение с сильными противогрибковыми азоловыми средствами (Итраконазол и др.), макролидными антибиотиками (Кларитромицин, Джозамицин, и др.), ингибиторами ВИЧ-протеазы (Ритонавир и др.), Нефазодоном;
- беременность и период грудного вскармливания;
- возраст менее 18 лет.
Оба препарата относятся к периферическим вазодилататорам. Они снижают пред- и постнагрузку на сердце, облегчая его работу. Спектр применения подобной комбинации недостаточно четко определен в настоящий момент. В основном такое сочетание препаратов используется при непереносимости или наличии противопоказаний к применению иАПФ или БРА.
- острый инфаркт миокарда в сочетании с выраженной артериальной гипотонией (систолическое артериальное давление ниже 100 мм рт.ст.);
- выраженная гипотония другого генеза (шок, сосудистый коллапс);
- закрытоугольная глаукома;
- черепно-мозговая травма;
- тяжелые пороки сердечных клапанов;
- дегидратация;
- геморрагический инсульт;
- детский возраст менее 18 лет;
- индивидуальная гиперчувствительность к препаратам.
К этой группе препаратов относится Дигоксин и другие сердечные гликозиды. В настоящий момент у больных с ХСН используется только Дигоксин (только в определенных клинических ситуациях). В нескольких исследованиях было продемонстрировано повышение риска фатальных сердечно-сосудистых событий у пациентов с ХСН, принимавших дигоксин.
Изначально средство использовалось для повышения сократительной способности миокарда. В настоящий момент Дигоксин не применяется как кардиотоник. Единственным показанием для его назначения является сочетание сердечной недостаточности с тахисистолической постоянной формой фибрилляции предсердий. Дигоксин не позволяет контролировать ритм, но эффективно урежает частоту сокращения желудочков сердца.
Большой проблемой при дозировании Дигоксина является его кумуляция в организме. В результате кумуляции содержание вещества в крови может в несколько раз превышать безопасный терапевтический диапазон. В этом случае возможно возникновение симптомов гликозидной интоксикации (желудочно-кишечные расстройства — рвота, тошнота, диарея, абдоминальный болевой синдром; нарушения в работе центральной нервной системы — головная боль, галлюцинации, нарушения зрения и цветовосприятия; нарушения сердечного ритма — тахи- и брадиаритмии. Использование Дигоксина показано, когда нет возможности принимать лекарственные средства с более благоприятным профилем безопасности.
- повышенная чувствительность к составляющим препарата;
- интоксикация сердечными гликозидами;
- атриовентрикулярная блокада II-III степени.
С большой осторожностью Дигоксин назначают при других нарушениях ритма, электролитных расстройствах, почечной недостаточности.
К этим средствам относятся:
- статины;
- полиненасыщенные жирные кислоты;
- антикоагулянты;
- антиагреганты;
- ингибиторы ренина.
Каждая группа препаратов имеет свою нишу применения. Статины и антиагреганты эффективны в отношении снижения смертности у пациентов с ишемической болезнью сердца и атеросклерозом других локализаций (аорта, сонные артерии, сосуды нижних конечностей), антикоагулянты — необходимый компонент лечения у пациентов с постоянной формой фибрилляции предсердий. В этих случаях они должны назначаться. Но применение этих групп лекарственных средств у больных ХСН, не имеющих специфических показаний к их назначению, не приводило к увеличению продолжительности жизни.
К лекарственным средствам, которые могут вызывать негативные последствия при применении у больных с сердечной недостаточностью, относятся недигидропиридиновые блокаторы каналов кальция. В ряде клинических испытаний было зафиксировано повышение смертности от СН при присоединении к лечению блокаторов кальциевых каналов.
Безопасность применения была выявлена только для дигидропиридовых блокаторов: Нифедипина и Фелодипина. Но даже эти средства следует назначать только по строгим показаниям.
Ухудшает течение сердечной недостаточности назначение тиазолидиндионов пациентам, страдающим сахарным диабетам.
Сравнительно недавно для лечения ХСН были одобрены ингибиторы рецепторов ангиотензина-наприлизина. Единственный представитель этого класса — препарат Юперио, содержащий сакубитрил и БРА — Валсартан. Вещества, входящие в состав лекарственного средства, повышают диурез и предотвращают процессы ремоделирования сердечной мышцы (гипертрофию и фиброз).

В настоящее время препарат еще не получил широкого распространения. Однако уже имеются положительные результаты клинической апробации Юперио, возможно в ближайшее время средство заслужит доверие врачей, занимающихся лечением сердечной недостаточности.
- гиперчувствительность к составляющим средства;
- совместный прием с любым представителем иАПФ;
- отек Квинке в анамнезе;
- одновременный прием с Алискиреном у лиц с сахарным диабетом или у пациентов, имеющих почечную патологию при нарушении функции почек — ХБП С3 и выше;
- цирроз печени класса С по классификации Чайлд Пью, билиарный цирроз и застой желчи;
- дети до 18 лет;
- период гестации и лактации;
- совместный прием со средствами, содержащими Валсартан.
В следующей таблице представлена минимальная, максимальная и средняя терапевтическая дозировка основных препаратов для лечения ХСН:
Источник: vashflebolog.com
Инновации в лечении сердечной недостаточности
ИННОВАЦИОННАЯ СТРАТЕГИЯ В ТЕРАПИИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Статья посвящена инновационному препарату для лечения хронической сердечной недостаточности – комбинации ингибитора неприлизина сакубитрила и антагониста рецепторов ангиотензина II первого типа валсартана (сакубитрил/ валсартан). Приведены результаты исследований, в которых сочетание сакубитрил/валсартан продемонстрировало эффективность у больных как с артериальной гипертензией, так и с сердечной недостаточностью. Показаны преимущества комбинации сакубитрил/валсартан по сравнению с другими препаратами, влияющими на компоненты ренин-ангиотензин-альдостероновой системы, с позиций безопасности и эффективности у больных с сердечной недостаточностью.
1. Tabrizchi R. Dual ACE and neutral endopeptidase inhibitors: novel therapy for patients with cardiovascular disorders. Drugs, 2003, 63: 2185-2202.
2. Kentsch M, Otter W. Novel neurohormonal modulators in cardiovascular disorders. The therapeutic potential of endopeptidase inhibitiors. Drugs R D, 1999 Apr, 1(4): 331-338.
3. Cruden NL, Fox KA, Ludlam CA et al. Neutral endopeptidase inhibition augments vascular actions of bradykinin in patients treated with angiotensin-converting enzyme inhibition. Hypertension, 2004, 44: 913-918.
4. Rademaker MT, Charles CJ, Espiner EA et al. Neutral endopeptidase inhibition: augmented atrial and brain natriuretic peptide, haemodynamic and natriuretic responses in ovine heart failure. Clin Sci (Lond), 1996, 91: 283-291.
5. Wilkinson IB, McEniery CM, Bongaerts KH et al. Adrenomedullin (ADM) in the human forearm vascular bed: effect of neutral endopeptidase inhibition and comparison with proadrenomedullin NH2-terminal 20 peptide (PAMP). Br J Clin Pharmacol, 2001, 52: 159-164.
6. Levin ER, Gardner DG, Samson WK. Natriuretic peptides. N Engl J Med, 1998, 339: 321-328.
7. Tabrizchi R. Dual ACE and neutral endopeptidase inhibitors: novel therapy for patients with cardiovascular disorders. Drugs, 2003, 63: 2185-2202.
8. Mukoyama M, Nakao K, Obata K. Augmented secretion of brain natriuretic peptide in acute myocardial infarction. Biochem Biophys Res Commun, 1991, 180: 431-436.
9. Protter AA, Wallace AM, Ferraris VA, Weishaar RE. Relaxant effect of human brain natriuretic peptide on human artery and vein tissue. Am J Hypertens, 1996 May, 9(5): 432-436.
10. Corti R, Burnett JC, Rouleau JL et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? Circulation, 2001, 104: 1856-1862.
11. Mangiafico S, Costello-Boerrigter LC, Andersen IA et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics. European Heart Journal, 2013, 34: 886-893.
12. Grantham JA, Borgeson DD, Burnett JC. BNP: pathophysiological and potential therapeutic roles in acute congestive heart failure. Am J Physiol, 1997, 92: 1077-1083.
13. Maeda K, Takayoshi T, Wada A et al. Plasma brain natriuretic peptide as a biochemical marker of high left ventricular end-diastolic pressure in patients with symptomatic left ventricular dysfunction. Am Heart J, 1998, 135: 825-832.
14. Muders F, Kromer EP, Griese DP et al. Evaluation of plasma natriuretic peptides as markers for left ventricular dysfunction. Am Heart J, 1997, 134: 442-449.
15. Tonne JM, Campbell JM, Cataliotti A et al. Secretion of glycosylated pro-B-type natriuretic peptide from normal cardiomyocytes. Clin Chem, 2011: 57864-57873.
16. Jensen KT, Carstens J, Pedersen EB. Effect of BNP on renal hemodynamics, tubular function and vasoactive hormones in humans. Am J Physiol, 1998, 274: 63-72.
17. De Bold AJ, Borenstein HB, Veress AT, Sonnenberg H. A rapid and potent natriuretic response to intravenous injection of atrial myocardial extract in rats. Life Sci, 1981, 28: 89-94.
18. Chen HH, Burnett JC Jr. C-type natriuretic peptide: the endothelial component of the natriuretic peptide system. J Cardiovasc Pharmacol, 1998, 32(Suppl. 3): S22-S28.
19. Chauhan SD, Hobbs AJ, Ahluwalia A. C-type natriuretic peptide: new candidate for endothelium-derived hyperpolarising factor. Int J Biochem Cell Biol, 2004, 36: 1878-1881.
20. Ichiki T, Huntley BK, Heublein DM et al. Corin is present in the normal human heart, kidney, and blood, with pro-B-type natriuretic peptide processing in the circulation. Clin Chem, 2011, 57: 40-47.
21. Wang TJ, Larson MG, Levy D et al. Impact of obesity on plasma natriuretic peptide levels. Circulation, 2004, 109: 594-600.
22. Belluardo P, Cataliotti A, Bonaiuto L et al. Lack of activation of molecular forms of the BNP system in human grade 1 hypertension and relationship to cardiac hypertrophy. Am J Physiol Heart Circ Physiol, 2006, 291: H1529-H1535.
23. Macheret F, Heublein D, Costello-Boerrigter LC et al. Human hypertension is characterized by a lack of activation of the anti-hypertensive cardiac hormones ANP and BNP. J Am Coll Cardiol, 2011, 57: 1386-1395.
24. Hawkridge AM, Heublein DM, Bergen HR 3rd et al. Quantitative mass spectral evidence for the absence of circulating brain natriuretic peptide (BNP-32) in severe human heart failure. Proc Natl Acad Sci USA, 2005, 102: 17442-17447.
25. Niederkofler EE, Kiernan UA, O’Rear J et al. Detection of endogenous B-type natriuretic peptide at very low concentrations in patients with heart failure. Circ Heart Fail, 2008, 1: 258-264.
26. Miller WL, Phelps MA, Wood CM et al. Comparison of mass spectrometry and clinical assay measurements of circulating fragments of B-type natriuretic peptide in patients with chronic heart failure. Circ Heart Fail, 2011, 4: 355-360.
27. Dries DL, Victor RG, Rame J et al. Corin gene minor allele defined by 2 missense mutations is common in blacks and associated with high blood pressure and hypertension. Circulation, 2005, 112: 2403–2410.
28. Chan JC, Knudson O, Wu F et al. Hypertension in mice lacking the proatrial natriuretic peptide convertase corin. Proc Natl Acad Sci USA, 2005, 102: 785-790.
29. Owan TE, Redfield MM. Epidemiology of diastolic heart failure. Prog Cardiovasc Dis, 2005, 47: 320-332.
30. The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med. 1991, 325: 293-302.
31. Garg R, Yusuf S. Overview of randomized trials of angiotensin-converting enzyme inhibitors on mortality and morbidity in patients with heart failure. Collaborative Group on ACE Inhibitor Trials. JAMA, 1995, 273: 1450-1456.
32. Rouleau JL, Pfeffer MA, Stewart DJ et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial. Lancet, 2000, 356(9230): 615-620.
33. Packer M, Califf RM, Konstam MA et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: the Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE). Circulation, 2002, 106: 920-926.
34. Kostis JB, Packer M, Black HR et al. Omapatrilat and enalapril in patients with hypertension: the Omapatrilat Cardiovascular Treatment vs. Enalapril (OCTAVE) trial. American Journal of Hypertension, 2004 February 1, 17(Issue 2): 103-111.
35. Cohn JN, Tognoni G. Valsartan Heart Failure Trial Investigators. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med, 2001, 345: 1667-1675.
36. Pfeffer MA, Swedberg K, Granger CB, CHARM Investigators and Committees. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme. Lancet, 2003, 362(9386): 759-66, 1667-1675.
37. McMurray JJ, Ostergren J, Swedberg K, CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function. taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet, 2003, 362(9386): 767-771.
38. Gu J, Noe A, Chandra P et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dual-acting angiotensin receptor-neprilysin inhibitor (ARNi). J Clin Pharmacol, 2010, 50: 401-414.
39. Hegde LG, Yu C, Renner T et al. Concomitant angiotensin AT1 receptor antagonism and neprilysin inhibition produces omapatrilat-like antihypertensive effects without promoting tracheal plasma extravasation in the rat. J Cardiovasc Pharmacol, 2011, 57: 495-504.
40. Ruilope LM, Dukat A, Buhm M et al. Blood pressure reduction with LCZ696, a novel dual acting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study. Lancet, 2010, 375: 1255-1266.
41. Solomon SD, Zile M, Pieske B et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial. Lancet, 2012, 380(9851): 1387-1395.
42. McMurray JJ, Packer M, Desai AS et al. Angiotensin-Neprilysin Inhibition versus Enalapril in Heart Failure. N Engl J Med, 2014, 371: 993-1004.
44. Desai AS, Vardeny O, Claggett B et al. Reduced Risk of Hyperkalemia During Treatment of Heart Failure With Mineralocorticoid Receptor Antagonists by Use of Sacubitril/Valsartan Compared With Enalapril: A Secondary Analysis of the PARADIGM-HF Trial. JAMA Cardiol, 2017 Jan 1, 2(1): 79-85.
45. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр). Сердечная недостаточность, 2013, 81(7): 379-472.
46. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail, 2016, 18(8): 891-975.
47. Seferovic JP, Claggett B, Seidelmann SB et al. Effect of sacubitril/valsartan versus enalapril on glycaemic control in patients with heart failure and diabetes: a post-hoc analysis from the PARADIGM-HF trial. Lancet Diabetes Endocrinol, 2017 May, 5(5): 333-340.
48. EMA, New medicine to treat heart failure recommended for approval. Available at: http:// www.ema.europa.eu/docs/en_GB/document_ library/EPAR_-_Public_assessment_report/ human/ 004062/WC500197538.pdf.
49. FDA. FDA approves new drug to treat heart failure. Available at: www.fda.gov/NewsEvents/ Newsroom/PressAnnouncements/ucm453845. htm.
51. Jhund PS, McMurray JJ. The neprilysin pathway in heart failure: a review and guide on the use of sacubitril/valsartan. Heart, 2016, 102(17): 1342-1347.
Инновационное лечение сердечной недостаточности
В августе 2017 года весь кардиологический мир был потрясен особенной новостью. В медицинском центре «Рамбам» специалистами в области инвазивной кардиологии было положено начало «терапевтическому прорыву» в области лечения диастолической сердечной недостаточности.
Это заболевание сопряжено с высокой смертностью – более 40% пациентов погибают в течение пяти лет с момента подтверждения диагноза. Диастолическая недостаточность мешает сердцу расслабиться после сокращения и вновь расшириться. При этом левый желудочек не может в нужном объеме наполниться кровью во время диастолы (расслабления), чтобы обеспечить ее достаточный выброс в момент систолы (сокращения). При малейших физических усилиях у больного возникает главный признак сердечной недостаточности – одышка, которая со временем вызывает мучения даже в состоянии покоя. Человек не может нормально дышать, подвержен отекам, а его органы страдают от нехватки кислорода и питательных веществ.
Для лечения таких пациентов израильской биотехнологической компанией CorAssist было разработано уникальное устройство CoRolla, представляющее собой пружинный механизм. Его функция заключается в том, чтобы после сокращения расширить сердечную мышцу до необходимых размеров. Таким образом обеспечивается высвобождение нормального потока крови к жизненно важным органам.
Первым пациентом, прошедшим успешное лечение, стал 72-летний гражданин Канады. Он специально прибыл на лечение в Израиль, поскольку ни на родине, ни где-либо еще за границей решение его проблемы пока не найдено. Процедура проходила без вскрытия грудной клетки и наркоза. Устройство CoRolla было имплантировано через катетер в режиме работающего сердца.
После установки сердечного расширителя мучительные симптомы отступили и состояние пациента значительно улучшилось. Операцией руководил заведующий кардиохирургическим отделением израильской больницы «Рамбам», профессор Гиль Болотин. Он отметил:
Значимость израильского изобретения бесценна – теперь можно спасти жизни больных, которые до его появления были обречены.
Напомним, что не так давно в кардиологическом отделении «Рамбам» с таким же абсолютным успехом и без осложнений была проведена операция по ангиопластике вице-премьеру Азербайджана Абиду Шарифову.
Мексиканские ученые открыли новые возможности в лечении сердечной недостаточности

Мексиканские врачи привели новые доказательства пользы рационального питания и умеренных занятий физкультурой при лечении сердечной недостаточности.
Доклад о проведённых исследованиях был зачитан на конгрессе кардиологов, состоявшемся в мексиканском городе Акапулько. Сюда ежегодно с 21 по 25 ноября съезжаются специалисты по лечению заболеваний сердца.
1. Понятие о сердечной недостаточности
В последние несколько десятилетий отмечается быстрый рост больных с заболеваниями сердца и сосудов. Число россиян, страдающих сердечной недостаточностью, приближается к 9 миллионам. А в Мексике количество таких больных составляет около 750 тысяч. Ежегодно данный диагноз ставится ещё 75 000 мексиканцев. И каждый год более 600 000 россиян умирает от этого недуга.
Главными симптомами недостаточной деятельности сердца являются сердцебиение и одышка во время физических нагрузок. При таком диагнозе кровь медленно циркулирует по сосудам, в результате чего ткани организма недополучают необходимые вещества.
Это происходит по элементарной причине. Миокард (слой сердечных мышц) не справляется со своими функциями. В более тяжёлых случаях отмечаются отёки и цианоз (посинение некоторых участков тела и слизистых покровов, обусловленное большим содержанием в крови восстановленного гемоглобина).
2. Исследования мексиканских кардиологов и польза контролируемых нагрузок
По словам кардиолога Артуро Ореа, исследующего проблему заболеваний сердца в мексиканском институте «Исмаэль Косио Вильегас», большинство людей с сердечной недостаточностью не живут более 5 лет.
По его статистическим данным, с таким недугом прожить более длительный срок смогут всего 38 процентов женщин и четвёртая часть заболевших мужчин. Соответствующее лечение улучшает состояние больных, но их будущее остаётся под вопросом.
Исследования Артуро Ореа выявили некоторые любопытные факты. Оказывается, что 57% больных с диагнозом «сердечная недостаточность» страдают от ожирения, у 40 процентов обнаружен сахарный диабет. Повышенное давление (артериальная гипертензия) диагностируется у 55% обследуемых, высокий уровень холестерина — у 41%, а продолжают курить, игнорируя запреты врачей, — 31 процент. И только 1 пациент из 100 продолжает сопротивляться болезни и вести активный образ жизни.
Группа мексиканских кардиологов подтверждает факт, что регулируемые физические нагрузки улучшают состояние больных с патологиями сердца. При сокращении мышц туловища и конечностей улучшается венозный отток крови. Некоторые врачи называют контролируемую физическую нагрузку «включением периферического сердца».
3. Правильно подобранная диета — лучшее лекарство

Одновременно с этим появляется всё больше сведений о пользе сбалансированного питания при лечении болезней сердца. При этом речь идёт о низкоуглеводной диете. По сообщениям А. Ореи, его подопечные в количестве 84 человек на протяжении 4 месяцев занимались лечебной физкультурой.
В это время в их рацион входила пища, состоящая на 30-40 процентов из протеинов и на 1/5 — из жиров. На остальную часть приходились углеводы. За эти 120 дней почти у всех пациентов уменьшилась отёчность и понизилось артериальное давление.
У другой группы заболевших из 38 человек, продолжавших проводить обычный образ жизни, таких изменений обнаружено не было.
Группу пациентов количеством 129 человек, страдавших недостаточностью сердечной деятельности, кардиологи исследовали на употребление продуктов, содержащих соли натрия и магния. Было установлено, что недостаток вышеуказанных элементов повышает вероятность летального исхода или госпитализации. И продолжительный дефицит соединений магния в организме человека в любом из случаев очень опасен.

Читайте далее — цена на Бетаксолол. Обзор цен на препарат.
В новости (ссылка) учащенный ритм сердца.
Завершая свой доклад, Артуро Ореа подчеркнул важность «магниевой диеты» для лиц, страдающих сердечной недостаточностью. Соединения этого элемента в большом количестве содержатся в гречке, орехах, овсе, кунжуте, маке и бобовых. Однако лучшим и легче всего усваиваемым источником магния являются листовые овощи.
Президент кардиологического общества Мексики Пенья Дуке, подводя итоги конгресса, сообщил об изменении причин развития сердечной недостаточности. По его словам, четверть века назад ключевым фактором для появления у человека недостаточной деятельности сердца был ревмокардит. В настоящий момент на первое место вышла ИБС (ишемическая болезнь сердца). И ключевая задача кардиологов — уменьшить смертность от этого недуга.
Вице-президент Европейского кардиологического общества Ш. Ахенбах поддержал своих мексиканских коллег. Он подчеркнул, что терапию сердечной недостаточности необходимо проводить в комплексе с регулируемой физической нагрузкой. А здоровый образ жизни с правильно сбалансированной диетой должен занять в этой проблеме центральное место.
Следует отметить, что в исследовании мексиканских учёных решается проблема хронической сердечной недостаточности, при которой больным не предписан постельный режим. Заниматься физической культурой пациентам с таким диагнозом следует с разрешения врача. При острой сердечной недостаточности повышенные нагрузки категорически запрещены и смертельно опасны!
Источник: dezkil.ru
 NEOSENSYS.COM Симптомы, диагностика и методы лечения заболеваний.
NEOSENSYS.COM Симптомы, диагностика и методы лечения заболеваний.
